Multiple Sklerose
Neurologie
Steckbrief
Die Multiple Sklerose (MS) ist eine chronische entzündliche Erkrankung des zentralen Nervensystems (ZNS) und die häufigste nicht traumatische Ursache einer Behinderung im jungen Erwachsenenalter. Die Diagnosestellung erfolgt anhand von Anamnese, klinisch-neurologischer Untersuchung, MRT-Bildgebung und Liquorbefund. Die Akuttherapie des Krankheitsschubes erfolgt primär durch eine Kortikosteroidpulstherapie. Eine frühzeitig initiierte Immuntherapie reduziert die Schubrate und in vielen Fällen das Fortschreiten der Behinderung, symptomatische Therapieansätze dienen der Linderung Multiple-Sklerose-assoziierter Symptome.Aktuelles
-
Die S2k-Leitlinie zur Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen wurde als „Living Guideline“ zuletzt im November 2023 überarbeitet und aktualisiert
-
Hierbei wurde der Stellenwert der MRT-Diagnostik zur Beurteilung von Krankheitsaktivität sowie zur Verlaufsprädiktion und Therapiewahl gestärkt. Mitoxantron soll aufgrund des Nebenwirkungs- und Sicherheitsprofils in der Therapie der Multiplen Sklerose nicht mehr zum Einsatz kommen
-
Ublituximab wurde Anfang 2024 als weiterer CD20-Antikörper zur Therapie der schubförmig-remittierenden Multiplen Sklerose (Kategorie 3) zugelassen. Die Medikation wird intravenös verabreicht
-
Ocrelizumab (CD20-Antikörper) wurde 2024 neben der bereits verfügbaren intravenösen auch in subcutaner Formulierung zur Therapie der schubförmig-remittierenden (Kategorie 3) und primär chronisch progredienten Multiplen Sklerose zugelassen
-
Rezente Studien legen nahe, dass eine Infektion mit Ebstein-Barr-Visus (EBV) eine ZNS-Autoimmunität unmittelbar triggern kann. Eine EBV-Infektion könnte somit eine obligate Voraussetzung zur Entwicklung einer Multiplen Sklerose darstellen
Synonyme
- Encephalomyelitis disseminata
Keywords
-
Multiple Sklerose
-
chronisch-entzündliche ZNS-Erkrankung
-
Demyelinisierung
-
klinisch isoliertes Syndrom
Definition
-
chronische immunvermittelte entzündliche Erkrankung mit Manifestation im Bereich des gesamten ZNS
-
schubförmige und chronisch-progrediente Verlaufsformen
-
autoimmunologische Entzündungsreaktion gegen Oligodendrozyten und Bestandteile der Myelinscheiden mit sekundärer axonaler Schädigung
Epidemiologie
Häufigkeit
-
häufige, chronisch verlaufende neurologische Erkrankung im Erwachsenenalter, weltweit ca. 2,8 Millionen Erkrankte; Prävalenz (pro 100.000 Einwohner) insgesamt 33, in Nord- und Mitteleuropa 120-300, Südeuropa 50-200, Nordamerika 250-290, Südamerika 5-40
-
regional unterschiedliche Prävalenz, Anstieg mit zunehmender Entfernung vom Äquator (Nord-Süd-Gefälle)
-
weltweite Inzidenz (pro 100000 Einwohner) 2,5, in Europa 3,8
-
in Deutschland leben gegenwärtig etwa 280.000 Erkrankte (Prävalenz ca. 320/100.000, Inzidenz 18/100.000 pro Jahr)
Altersgipfel
-
Haupterkrankungsalter zwischen dem 20. und 40. Lebensjahr (weltweit mittleres Alter 29,2 Jahre)
-
die Krankheit kann auch bei Kindern und Jugendlichen auftreten und sich selten im höheren Lebensalter manifestieren
Geschlechtsverteilung
-
Gynäkotropie, es ist vermehrt des weibliche Geschlecht betroffen. Das Verhältnis der Erkrankten weiblichen zu männlichen Geschlechts beträgt 2–3:1
Prädisponierende Faktoren
-
familiäre Belastung: Erkrankungsrisiko in der Allgemeinbevölkerung ca. 0,25%; Nachkommen eines MS-Elternteils 2%, Geschwister eines MS-Patienten 3,5%, Nachkomme zweier MS-Elternteile 12%
-
Gene: Assoziation mit dem Humanen Leukozytenantigen-System (HLA; 20-30% der genetischen MS-Suszeptibilität betrifft HLA-Merkmale, insbesondere HLA-DRB1*15 (Risikoerhöhung ca. 3-fach)) und vielen meist Immunsystem assoziierten Genpolymorphismen (u.a. IL7R, IL2RA, CD58, STAT3)
-
ethnische Abstammung: Hohe Prävalenz bei Europäern, weißen Nordamerikanern und Australiern. Niedrigere Prävalenz bei Afroamerikanern, Mexikanern, Chinesen
-
Umweltfaktoren: Infektion mit Epstein-Barr-Virus (EBV), Rauchen, Vitamin D Mangel, Übergewicht
Ätiologie und Pathogenese
- Ursache der Multiplen Sklerose unklar, sehr wahrscheinlich autoimmunologische Entzündungsreaktion gegen die Oligodendrozyten und Myelinschicht im ZNS
- histopathologisch multiple disseminierte Demyelinisierungsherde („Plaque“) im Bereich der Weißen und Grauen Substanz, häufig in perivenöser Lokalisation, innerhalb der Plaques Infiltrate aus T-Lymphozyten, B-Lymphozyten, Plasmazellen und Makrophagen
- nach abgelaufener Entzündungsreaktion Nachweis einer Astrogliose, zudem häufig inkompletter Remyelinisierungsprozess, bereits im Frühstadium axonale Degeneration
- der Hypothese nach Aktivierung von autoreaktiven T- und B-Zellen außerhalb des ZNS in der Peripherie (infektgetriggert, z.B. im Rahmen einer EBV-Infektion, dann Kreuzreaktion mit Autoantigenen), nach Migration in das ZNS (Venen, Plexus choroideus) durch diese Produktion proinflammatorischer Zytokine im perivaskulären Raum, dadurch Störung der Blut-Hirn-Schranke mit Infiltration weiterer Immunzellen, insbesondere Makrophagen
Klassifikation und Risikostratifizierung
-
klinisch isoliertes Syndrom (KIS): Erstmalige schubartige klinische Manifestation, oft klinisch oder paraklinisch Nachweis einer örtlichen Dissemination, jedoch fehlende zeitliche Dissemination
-
schubförmig remittierende Multiple Sklerose (RRMS): Nachweis einer örtlichen und zeitlichen Dissemination, mindestens ein eindeutig abgrenzbarer Schub; bei Erkrankungsbeginn vorherrschende Verlaufsform (80% aller Patienten)
-
sekundär chronisch-progrediente Multiple Sklerose (SPMS): progrediente Zunahme neurologischer Defizite unabhängig von Schubereignissen mit oder ohne aufgesetzte Schübe (15% aller Patienten); Übergang aus RRMS
-
primär chronisch-progrediente Multiple Sklerose (PPMS): von Beginn an chronisch progrediente Krankheitssymptome ohne sicher abgrenzbare Schübe (5% aller Patienten)
-
radiologisch isoliertes Syndrom (RIS): inzidenteller Nachweis MS-typischer Läsionen in der MRT-Bildgebung mit räumlicher, teils auch zeitlicher Dissemination; in 34% innerhalb von 5 Jahren Übergang in klinisch manifeste MS (90% RRMS, 10% PPMS)
-
demyelinisierendes Ereignis ungeklärter Signifikanz (DME): Schubartiges klinisches Ereignis ohne Nachweis einer örtlichen und zeitlichen Dissemination (Beispiele: Isolierte Sehnervenentzündung, isolierte Myelitis)
Symptomatik
-
Die MS kann alle Funktionssysteme des ZNS betreffen und bietet somit ein breites klinisches Bild („Chamäleon der Neurologie“)
-
Sehstörungen: Visusminderung (Neuritis nervi optici), Doppelbilder (Okulomotorikstörung), selten Gesichtsfeldausfälle
-
Sensibilitätsstörungen: Hyp-, Par-, Dysästhesien, Lhermitte-Phänomen, Pallhypästhesie
-
motorische Störungen: spastische Mono-, Para, Hemiparese, Reflexsteigerung, Pyramidenbahnzeichen, Ausfall der Bauchhautreflexe
-
zerebelläre Störungen: Ataxie, Dysmetrie, Intentionstremor, Rebound-Phänomen, Dysdiadochokinese, Dysarthrie
-
Hirnstammsymptome: Trigeminusneuralgie, faziale Parese, faziale Myokymien
-
Blasen-/Mastdarmstörungen: Inkontinenz, imperativer Harn- oder Stuhldrang, Harnretention
-
Sexualfunktionsstörungen: erektile Dysfunktion, Libidoverlust
-
kognitive Störungen: Konzentrationsdefizite, Merkfähigkeitsstörungen, Störungen der Aufmerksamkeit, Demenz
-
affektive Störungen: Depression, Euphorie, bipolare Störung, Psychose
-
Erschöpfungssyndrom („Fatigue“)
-
nur selten: epileptische Anfälle, Aphasie, Hemianopsie, Kopfschmerzen, Vigilanzminderung
Diagnostik
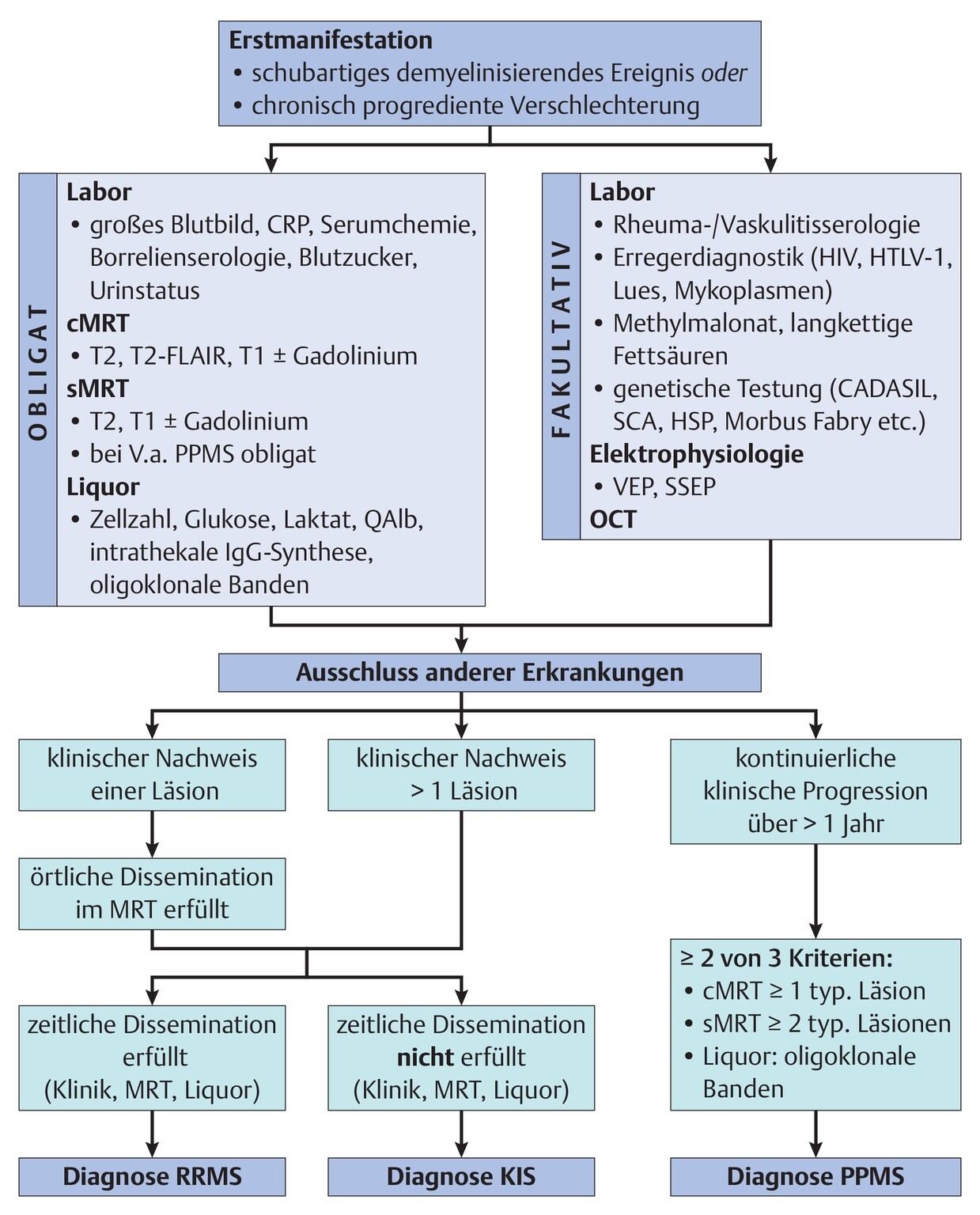
Diagnostisches Vorgehen
-
Diagnosestellung der Multiplen Sklerose anhand der McDonald-Kriterien in der revidierten Fassung von 2017
-
Diagnostik anhand von Anamnese, klinischer Objektivierung der neurologischen Ausfallsymptomatik, klinischem und/oder paraklinischem Nachweis von zeitlich und örtlich disseminierten Entzündungsvorgängen im Bereich des ZNS (Abb. 65.1)
-
Diagnose schubförmiger Verlaufsformen:
-
Schub: neurologische Ausfallsymptomatik über mind. 24 Stunden mit mind. 30-tägigem Abstand zu einer vorausgegangenen Episode, nicht durch einen vorliegenden Infekt, Änderung der Körpertemperatur (Uhthoff-Phänomen) oder andere organische Ursache erklärbar. Auch atypische Präsentationen (neuropsychiatrische Symptome, isolierte schwere Fatigue, epileptische Anfälle, wiederholte paroxysmale Ereignisse über > 24 Stunden) möglich.
-
räumliche Dissemination:
-
klinisch: klinisch objektivierbare Evidenz von zwei oder mehr Läsionen im Bereich des ZNS, z.B. Affektion des N. opticus (einseitige Sehstörung) und des Myelons (Querschnittssymptomatik) oder
-
klinisch unterstützt durch MRT: eine klinisch objektivierbare Läsion des ZNS und Nachweis von mindestens einer T2-hyperintensen Läsion mittels MRT in mindestens 2 von 4 MS-typischen Regionen: periventrikulär, juxtakortikal/kortikal, infratentoriell, spinal (Läsion symptomatisch oder asymptomatisch)
-
-
zeitliche Dissemination:
-
zum Zeitpunkt des ersten Schubs: simultaner Nachweis mindestens einer Gadolinium-aufnehmenden Läsion und einer nicht Gadolinium-aufnehmenden Läsionen im MRT oder
-
zum Zeitpunkt des ersten Schubs: Nachweis liquorspezifischer oligoklonaler Banden oder
-
im weiteren Krankheitsverlauf: klinischer Nachweis eines zweiten Schubes oder Nachweis einer neuen T2-hyperintensen oder Gadolinium-aufnehmenden Läsion in einem Folge-MRT
-
-
Diagnose DME: ein Schub, keine örtliche und keine zeitliche Dissemination
-
Diagnose KIS: ein Schub bei dem nur das Kriterium der räumlichen Dissemination erfüllt ist
-
Diagnose RRMS: mindestens ein Schub und Nachweis einer räumlichen und zeitlichen Dissemination
-
-
Diagnose progredienter Verlaufsformen:
-
Diagnose SPMS: Nachweis einer von Schüben unabhängigen Zunahme der Behinderung über einen Zeitraum von 6 bis 12 Monaten im Verlauf der Erkrankung
-
Diagnose PPMS: kontinuierliche Verschlechterung mindestens eines klinisch objektivierbaren Defizits über mindestens 12 Monate und Nachweis von mindestens 2 der 3 Befunde: mindestens eine Läsion in einer MS-typischen Region im zerebraler MRT, Nachweis von mindestens 2 Läsionen in spinaler MRT, Nachweis liquorspezifischer oligoklonaler Banden
-
Abb. 65.1 Diagnostischer Algorithmus bei Verdacht auf Multiple Sklerose.
Fakultative Untersuchungen in Abhängigkeit von klinischer Manifestation und möglichen Differenzialdiagnosen. AQP-4: Aquaporin-4, CADASIL: „cerebral aurtosomal dominant arteriopathy with subcortical infarcts and leukencephalopathy, cMRT: kraniale Magentresonanztomografie, DME: Demyelinisierendes Ereignis unklarer Signifikanz, FLAIR: “fluid attenuated inversion recovery”, KIS: klinisch isoliertes Syndrom, MRT: Magentresonanztomografie, MOG: Myelin-Oligodendrozyten-Glykoprotein, OCT: optische Kohärenztomografie, OKB: oligoklonale Banden, PPMS: primär chronisch progrediente Multiple Sklerose, QAlb: Albumin-Liquor-Serum-Quotient, QIgG: Immunglobulin G- Liquor-Serum-Quotient, QIgM: Immunglobulin M- Liquor-Serum-Quotient, RRMS: schubförmig remittierende Multiple Sklerose, SEP: somatosensibel evozierte Potenziale, sMRT: spinale Magentresonanztomografie, VEP: visuell evozierte Potenziale
Anamnese
- Anamnese hinsichtlich Art, Dauer und Kinetik der Beschwerden inklusive Abfrage von Blasen-/Mastdarmstörungen und Einschränkungen der Sexualfunktion
- Erfragen stattgehabter, MS-typischer Symptome in der Vergangenheit
- obligate Abfrage weniger offensichtlicher Symptome, wie Konzentrationsstörungen, verfrühte körperliche/geistige Erschöpfung (Fatigue), psychische Störungen, Schmerzen
- obligat Anamnese hinsichtlich Vorerkrankungen (weitere Autoimmunerkrankungen), Familienanamnese, Sozialanamnese
Körperliche Untersuchung
-
obligat vollständige klinisch neurologische Untersuchung inklusive Erhebung des Visus
-
Quantifizierung der Defizite mittels MS-spezifischer Tests (z.B. Expanded Dissability Status Scale (EDSS)) (fakultativ)
-
bei Einschränkung der Gehfähigkeit (<1km ohne Pause) Bestimmung der maximalen Gehstrecke (fakultativ)
-
frühzeitig bei entsprechenden Beschwerden neuropsychologische Testung (fakultativ)
Labor
-
bei Erstdiagnose obligate Bestimmung eines großen Blutbildes mit Serumchemie (Natrium, Kalium, Kreatinin, Harnstoff, GOT, GPT, γ-GT, CRP, BSG, Blutzucker und Urinstatus)
-
bei anamnestischen Hinweisen für eine systemische Erkrankung oder Nachweis von Laborauffälligkeiten (insbesondere CRP- und BSG-Erhöhung) weitere rheumatologische (z.B. ANA [antinukleäre Antikörper], ANCA [antineutrophile zytoplasmatische Antikörper]) und infektiologische Diagnostik (z.B. HIV) empfohlen
-
weitere Laborkontrollen im Krankheitsverlauf abhängig von der jeweils geplanten Immuntherapie (Tab. 65.3)
Serologie
-
bei Erstdiagnose obligate Bestimmung einer Borrelien- und Lues-Serologie im Serum, bei positivem Befund auch im Liquor
-
bei anamnestischen, klinischen oder paraklinischen Hinweisen für Differenzialdiagnosen weitere rheumatologische Diagnostik (z.B. antinukleäre Antiörper [ANA], anti-Neutrophile zytoplasmatische Antikörper [ANCA], anti-Doppelstrang-DNA-Antikörper), infektiologische Diagnostik (z.B. HIV-Suchtest, HTLV-1 PCR) oder autoimmunologische Diagnostik (z.B. anti-Aquaporin-4 Antikörper; anti-Myelin-Oligodendrozyten-Glykoprotein [MOG] Antikörper) empfehlenswert.
-
weitere Laborkontrollen im Krankheitsverlauf abhängig von der jeweils geplanten Immuntherapie (Tab. 65.1).
Liquordiagnostik
-
Bedeutung im Rahmen der Initialdiagnostik zur Diagnosesicherung (zeitliche Dissemination, PPMS), differenzialdiagnostischen Abgrenzung und Prognoseabschätzung
-
obligat Bestimmung von Zellzahl, Differenzialzellbild, Lactat, Liquor-Serum-Quotienten für Albumin (QAlb) und IgG (QIgG) nach Reiber, Untersuchung auf liquorspezifische oligoklonale Banden (Abb. 65.1)
-
bei positiver Serum-Serologie für Borrelien oder Lues ergänzende Serologie im Liquor
-
fakultativ Bestimmung des Liquor-Serum-Quotienten für IgA (QIgA) und IgM (QIgM) sowie der intrathekalen Bildung von Antikörpern gegen Masern-, Röteln- und Varizella Zoster Viren (MRZ-Reaktion), Liquor-Durchflusszytometrie
-
30–60% mit leichter Pleozytose (bis 50/µl), Einzelfälle bis 100/µl, >100/µl untypisch; sehr häufig erhöhter B-Zell-Anteil (>1,4% aller CD45+-Zellen)
-
liquorspezifische oligoklonale IgG-Banden bei 95% aller MS-Patienten, jedoch nicht MS-spezifisch
-
bei 70–80% erhöhter Liquor-Serum-IgG-Index (>0,7), 20–30% mit intrathekaler IgM-Synthese; untypisch sind eine dominante intrathekale IgA- (>25%) oder eine Dreiklassensynthese, hier sind differenzialdiagnostische Überlegungen angezeigt
-
QAlb in 70–80% normwertig, leichte Schrankenstörung möglich (QAlb 8–10×10– 3)
-
bei Auffälligkeiten in der Liquordiagnostik (keine oligoklonalen Banden im Liquor, Zellzahl > 50/µl, ausgeprägte Schrankenstörung, intrathekale IgA-Synthese) sollten ein infektiologisches Geschehen, andere systemische Autoimmunerkrankungen oder eine vaskuläre Genese in Erwägung gezogen werden
Bildgebende Diagnostik
Retinale optische Kohärenztomografie (OCT)
-
visuelle Darstellung verschiedener Retinaschichten mittels Breitbandlichtstrahl („spectral domain“)
-
Nachweis abgelaufener Optikusneuritiden sowie retrograder transaxonaler Atrophieprozesse im Bereich des ZNS
MRT
Zerebrales MRT
-
Nachweis klinisch stummer cerebraler Demyelinisierungsherde (paraklinische Krankheitsaktivität), Bedeutung in der Differenzialdiagnostik
-
bei Erstdiagnose obligat
-
abhängig von Therapie und Klinik regelmäßige cMRT-Verlaufskontrollen zur Überwachung des Krankheitsverlaufs sinnvoll (6 Monate nach Erstdiagnose oder Therapiebeginn, dann alle 12 Monate)
-
empfohlene Sequenzen im kranialen MRT: T2-FLAIR axial und sagittal oder 3D isotrop (periventrikuläre und juxtakortikale Läsionen), T2 axial oder 3D isotrop (infratentorielle Läsionen), T1 axial (+/- Gadolinium) (Abb. 65.2 A-E); Schichtdicke maximal 3 mm; In-plane-Auflösung maximal 1 x 1 mm; ggf. Double-Inversion-Recovery (DIR)(kortikale/juxtakortikale Läsionen)
-
aufgrund möglicher Gadolinium-Ablagerungen im Gehirngewebe strenge Indikationsstellung für Gadolinium-Gaben (z.B. Erstdiagnose, Auftreten ungewöhnlicher Läsionen, Therapiekomplikationen). Für Verlaufsuntersuchungen sind bei guter Standardisierung der Sequenzen T2- und T2-FLAIR-Sequenzen ausreichend
-
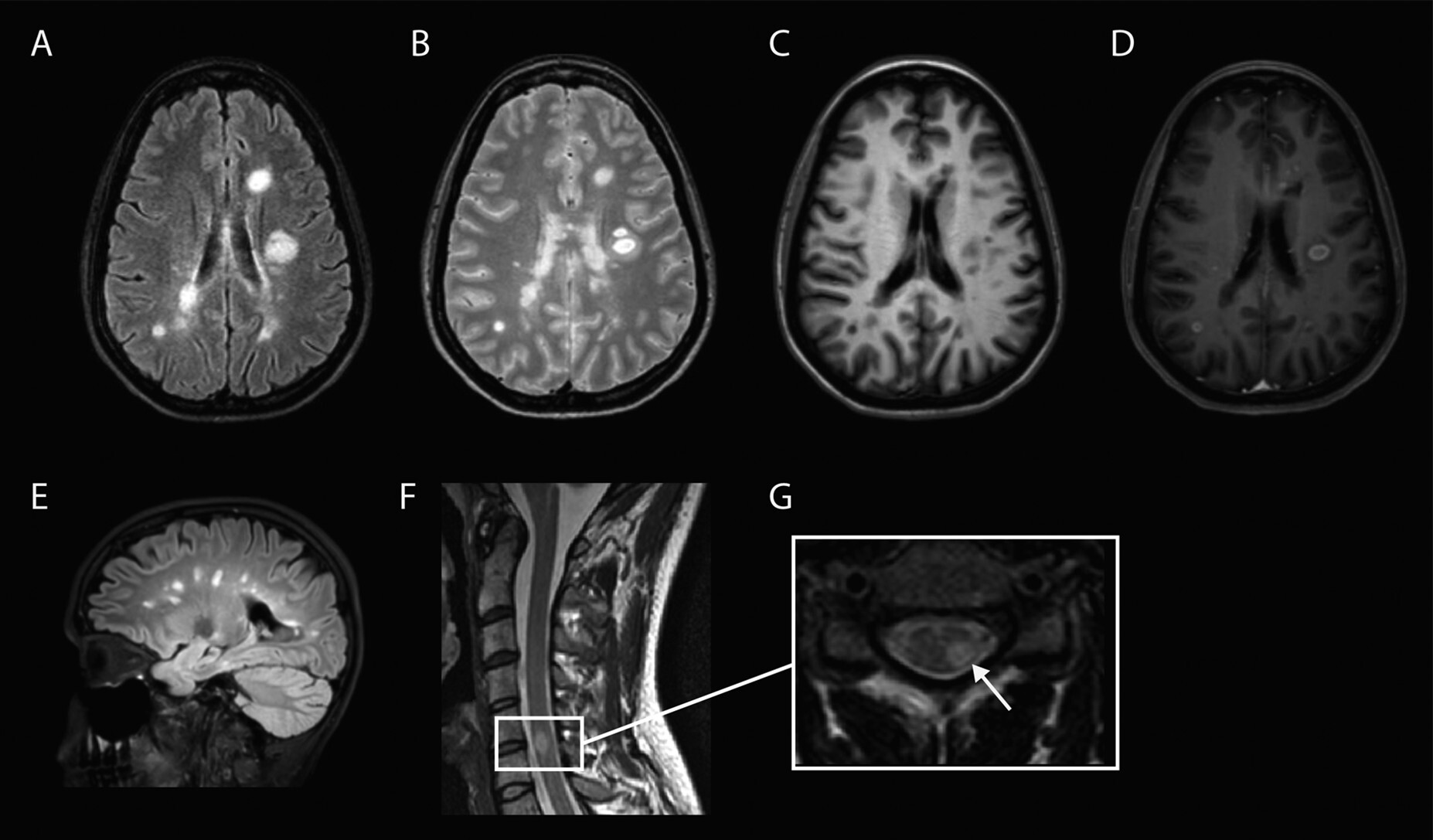
typische Läsionsorte: Corpus callosum (Abb. 65.2), temporal, periventrikulär, infratentoriell, spinal. Läsionen meist ovalär konfiguriert und in perivenöser Lage. Mindestdurchmesser 3mm. Gadolinium-Aufnahme der Läsionen zeigt Schrankenstörung und damit akute Entzündung an (Abb. 65.2)
-
bei Auffälligkeiten in der MRT-Diagnostik (raumfordernde Läsionen, konfluierende Marklagerläsionen bei Erstmanifestation, fokale Atrophien des Balkens und Cerebellums, Läsionen der Basalganglien) müssen andere demyelinisierende, granulomatöse Erkrankungen, ein infektiologisches Geschehen oder Leukodystrophie, neurogenetische, neurodegenerative und nutritiv-toxische Erkrankungen in Erwägung ziehen. Bei meningealer Kontrastmittel-Aufnahme sollte eine Meningeosis neoplastica differenzialdiagnostisch bedacht werden
Abb. 65.2 Typische Befunde in der MRT-Bildgebung bei Patienten mit Multipler Sklerose.
A–E Zerebral multiple, ovalär konfigurierte Läsionen in periventrikulärer und juxtakortikaler Lage. Läsionen erscheinen hyperintens in T2-FLAIR (A: axial, E: sagittal) und T2 (B: axial) und hypointens in nativer T1-Sequenz (C: axial). Aktive, schrankengestörte Läsionen stellen sich nach Gadolinium-Gabe hyperintens in T1 (D: axial) dar. F–G: Halswirbelsäulen-MRT, T2-Sequenz; meist kurzstreckige (F), T2-hyperintese Läsionen in lateraler Lage (G, axial, Pfeil). (Quelle: Prof. Dr. med. C. Zimmer, Abteilung für Neuroradiologie, Klinikum rechts der Isar der TU München)
Spinales MRT
- MRT-Untersuchung des gesamten Myelons im Rahmen der Erstdiagnose obligat (Diagnosesicherung, Differenzialdiagnose [z.B. NMO], Prognose)
- spinale MRT-Verlaufskontrollen nach Klini
- empfohlene Sequenzen: T2 axial und sagittal, T1 sagittal (+/- Gadolinium), Schichtdicke maximal 3 mm (sagittal) bzw. 5 mm (axial); In-plane-Auflösung sagittal maximal 0,75 x 0,75 mm, axial maximal 0,5 x 0,5 mm
- Nachweis spinaler Läsionen bei 74–85% aller MS-Patienten
- typischerweise kurzstreckige (<3 Wirbelkörper) T2-hyperintense Läsionen, meist lateral gelegen (Abb. 65.2)
- eine isolierte Hinterstrangaffektion oder eine transverse Myelitis sind untypisch und sollten an Differenzialdiagnosen (siehe Tab. 65.1) denken lassen
Instrumentelle Diagnostik
Evozierte Potenziale
- apparative Objektivierung von Läsionen im Bereich des ZNS, Nachweis einer subklinischen Krankheitsdissemination
- Bedeutung in der Differenzialdiagnostik
- Ableitung visuell evozierter Potenziale (VEP), somatosensibel evozierter Potenziale (SEP – oft N. medianus, N. tibialis) und magnetisch evozierter Potenziale
Histologie, Zytologie und klinische Pathologie
Gehirnbiopsie
-
Diagnosestellung durch die dargestellten Diagnostika in der Regel ausreichend belastbar, Durchführung einer Gehirnbiopsie nur in absoluten Ausnahmefällen
-
Indikation: differenzialdiagnostische Einordnung atypischer, meist tumefaktiver Gehirnläsionen (vor allem ZNS-Lymphom, Gliom, infektiöse Leukenzephalopathien, s. Kap. Differenzialdiagnosen) oder atypischer Läsionen im Rahmen immunsuppressiver Behandlungen, wenn eine Diagnose mit anderen Methoden nicht etabliert werden kann
Differenzialdiagnosen
Wichtige Differenzialdiagnosen der Multiplen Sklerose sind in Tab. 65.1 angegeben [9].|
monophasiche mulifokale neurologische Symptomatik mit Zeichen einer Encephalopathie, diffuse entzündliche Veränderungen mit Einbeziehung der Thalami und Basalganglien, meist im Kindesalter nach Infektionen |
|
|
langstreckige, median gelegene spinale Läsionen (>3 Wirbelkörperhöhen), oft beidseitige Neuritis Nervi Optici, Hirnstamm– und Zwischenhirnsyndrome, Bestimmung von anti-AQP4 Antikörper im Serum |
|
|
MOG-IgG assoziierte Erkrankungen (MOGAD) |
NMOSD Phänotyp bei Erwachsenen, typisch beidseitige anteriore Neuritis Nervi Optici, ADEM Phänotyp bei Kindern, Bestimmung von anti-MOG-Antikörper im Serum |
|
Uveitis, rezidivierende orale und genitale Aphten, vor allem bei Patienten aus dem Mittleren Osten, Assoziation mit HLA-B51, auffälliger Pathergie-Test |
|
|
typischerweise radikuläre Symptomatik; Differenzierung mittels Serologie und Liquorbefund (spezifische intrathekale Antikörpersynthese) |
|
|
dominante Hinterstrangsymptomatik (Tabes dorsalis), Differenzierung mittels Serologie und Liquorbefund |
|
|
oft meningeale Affektion; falls systemisches Staging nicht wegweisend ggf. Hirnbiopsie |
|
|
oft organisches Psychosyndrom, epileptische Anfälle, eher flächige Leukenzephalopathie; Differenzierung mittels systemischem Staging und Rheumaserologie |
|
|
im Verlauf retinale Vaskulopathie, Innenohrschwerhörigkeit, hauptsächlich zentrale Balkenläsionen („snowball lesions“); Differenzierung mittels Audiometrie, retinaler Fluoreszenzangiografie, optische Kohärenztomografie |
|
|
abhängig vom Vaskulitistyp Gefäßkalibersprünge, mehrzeitige disseminierte Infarkte, Mikroblutungen; digitale Subtraktionsangiografie, systemisches Staging; falls nicht wegweisend ggf. Hirnbiopsie |
|
|
kognitive Einschränkung, diffuse Leukenzephalopathie, Differenzierung mittels HIV-Serologie |
|
|
häufig multifokale, teils raumfordernde Läsionen mit Schrankenstörung; Liquordiagnostik mit Durchflusszytometrie, systemisches Staging; falls nicht wegweisend ggf. Hirnbiopsie |
|
|
Familienanamnese (weitere Erkrankungsfälle, Konsanguinität), atypische klinische (z.B. zusätzlicher Befall des PNS) oder kernspintomografische Befunde, ggf. gezielte genetische Testung oder Exom-Sequenzierung |
|
|
subkortikale Leukenzephalopathie mit mehrzeitigen Ischämien, oft frontotemporal; autosomal-dominante Genetik; oft anamnestisch Migräne; Diagnostik mittels Hautbiopsie (Notch-3-Ablagerung in der Gefäßmedia) oder genetischer Testung (Notch-3-Punktmutation) |
|
|
AQP-4: Aquaporin-4, MOG: Myelin-Oligodendrozyten-Glykoprotein, HLA: Humanes Leukozytenantigen, HIV: Humanes Immundefizienzvirus, CADASIL: „cerebral autosomal dominant arteriopathy with subcortical infarcts and leukencephalopathy“ |
|
Therapie
-
in der Therapie der Multiplen Sklerosen werden die pharmakologische Schubtherapie, die krankheitsmodifizierende Verlaufstherapie sowie die symptomatische Therapie unterschieden.
-
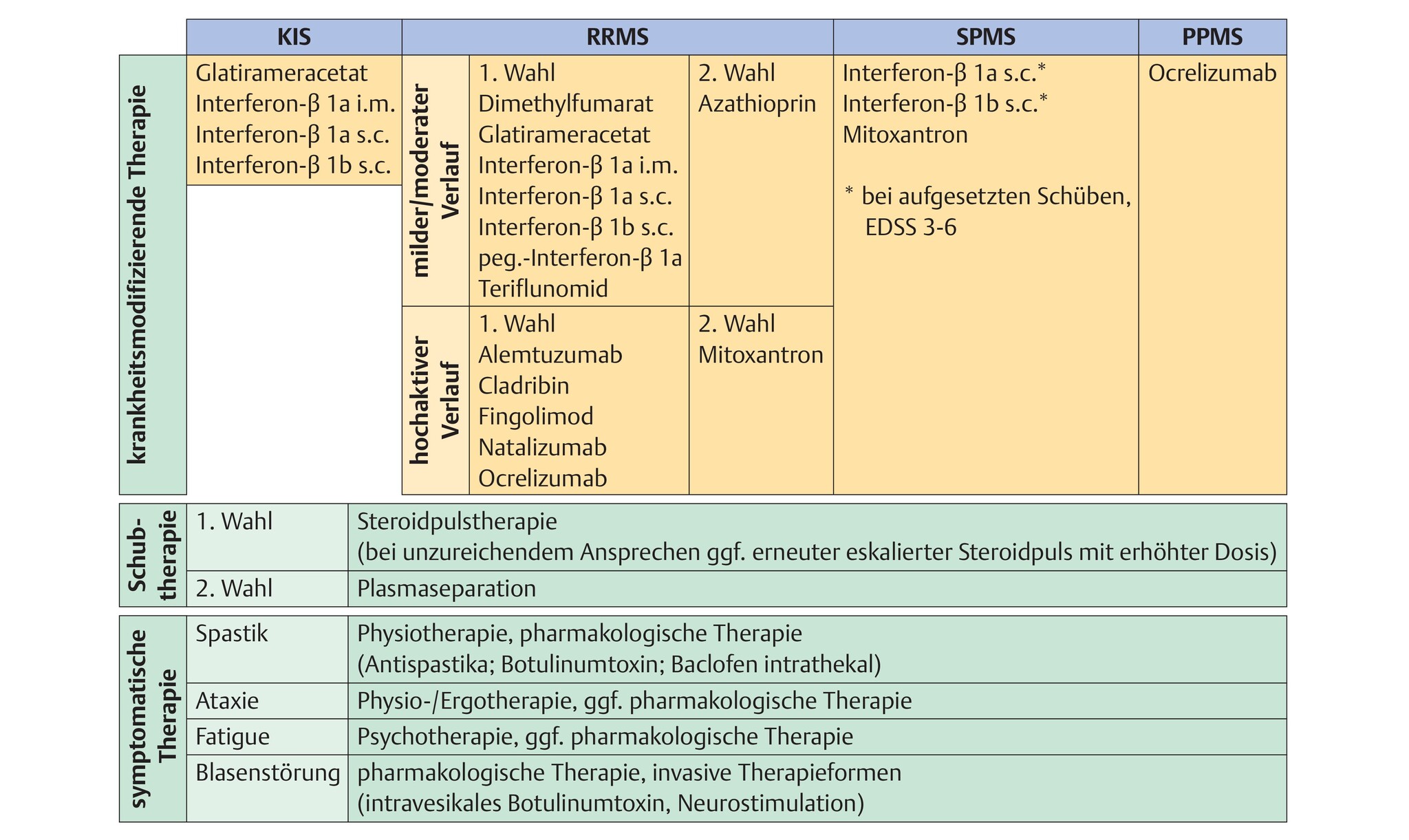
während die pharmakologische Schubtherapie sowie die symptomatischen Therapieansätze bei allen MS-Verlaufsformen angewendet werden können, ergeben sich hinsichtlich der verlaufsmodifizierenden Immuntherapie Unterschiede zwischen den Unterformen (Abb. 65.3).
Abb. 65.3 Verschiede Therapieansätze bei klinisch isoliertem Syndrom (KIS), schubförmig remittierender Multipler Sklerose (RRMS), sekundär chronisch-progredienter Multipler Sklerose (SPMS) und primär chronisch-progredienter Multipler Sklerose (PPMS).
Die Reihenfolge der pharmakologischen Substanzen ist alphabetisch bzw. nach Zulassung und spiegelt keine therapeutische Überlegenheit oder Potenz wider.
Verlaufsmodifizierende Therapie der Multiplen Sklerose
-
die pharmakologische verlaufsmodifizierende Therapie dient der Reduktion der Schubaktivität und Abmilderung der Behinderungsprogression
-
das Therapieziel besteht in der bestmöglichen Reduktion der MS-Krankheitsaktivität. Im Idealfall soll unter Therapie keine messbare Krankheitsaktivität vorliegen (keine Schübe, keine neuen Läsionen im MRT, keine EDSS-Progression; NEDA-3 Konzept: No Evidence of Disease Activity)
-
die zu erwartenden Therapieeffekte sollten immer gegen das Sicherheitsprofil und zu erwartende Nebenwirkungen abgewogen werden
-
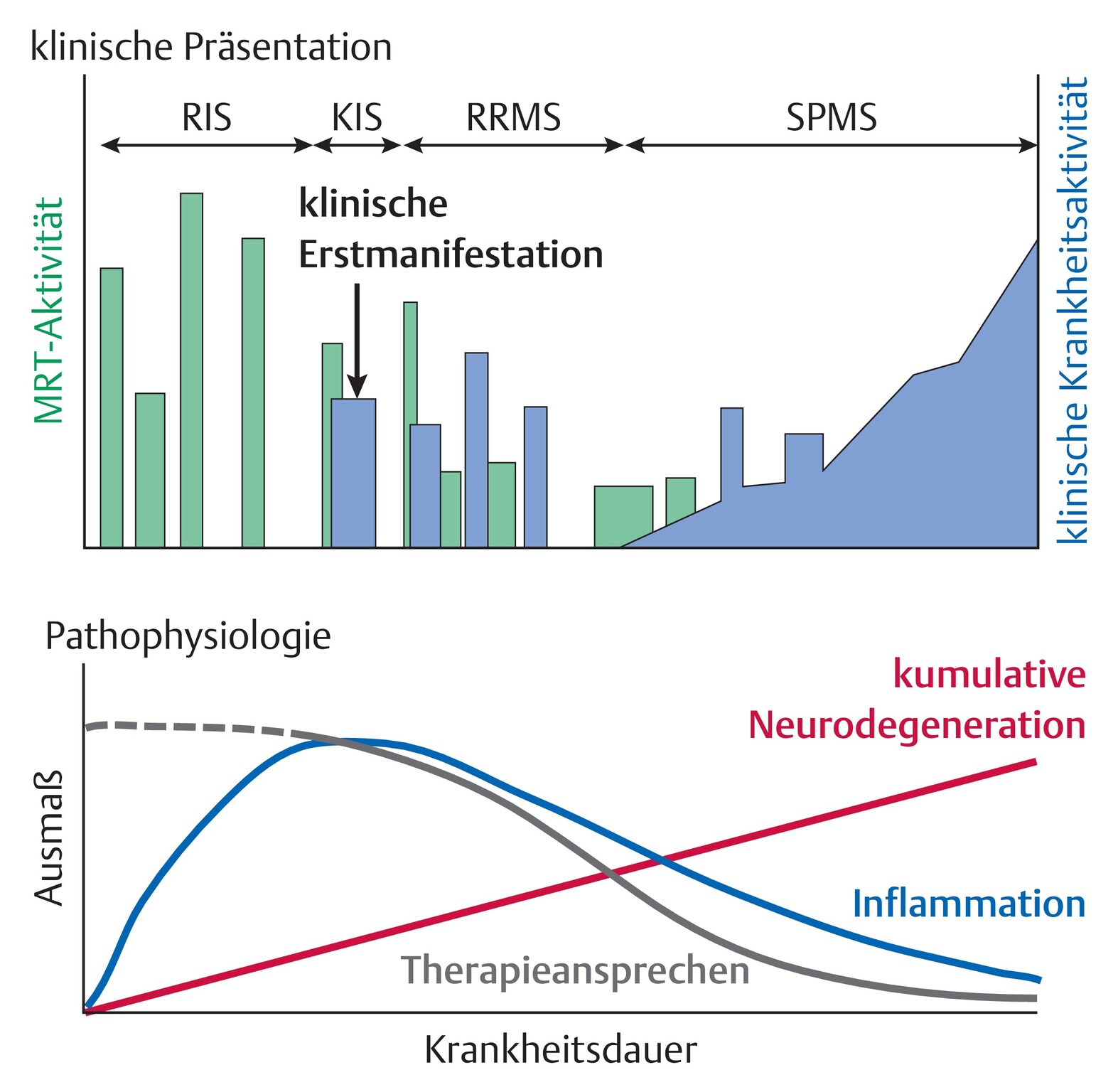
das Therapieansprechen auf eine verlaufsmodifizierende Therapie ist umso besser, je früher diese nach klinischer Erstmanifestation initiiert wird (Abb. 65.4), weshalb ein frühzeitiger Therapiebeginn empfohlen wird
-
die Therapieeffekte auf Schubraten, durch Schübe verursachte Behinderungsprogression oder MRT-Parameter sind am größten in der RRMS. In progredienten Phasen (PPMS, nicht-aktive SPMS) sind Immuntherapien nur noch gering bis nicht mehr wirksam
Abb. 65.4 Pathophysiologische Vorgänge im Krankheitsverlauf der Multiplen Sklerose.
In der Frühphase der Erkrankung dominieren inflammatorische Vorgänge, die oftmals gut auf immunmodulatorische Therapieansätze ansprechen; in der Spätphase vor allem neurodegenerative Vorgänge, die nur unzureichend therapeutisch beeinflusst werden können; KIS: klinisch isoliertes Syndrom, RIS: radiologisch isoliertes Syndrom, RRMS: schubförmig remittierende Multiple Sklerose, SPMS: sekundär chronisch-progrediente Multiple Sklerose.
Therapie der schubförmig remittierenden Multiplen Sklerose
- die Wahl der Immuntherapie erfolgt nach vorliegender Erkrankungsaktivität unter Berücksichtigung der Schubrate und Schubschwere, der paraklinischen Krankheitsaktivtät im cMRT, Ansprechen auf Schubtherapien und Behinderungsprogression. Hierbei soll der anzunehmende Nutzen gegen Risiken und individuelle Patientenmerkmale (Komorbiditäten) abgewogen werden
- die Therapieeffekte der Immuntherapeutika werden nach relativer Reduktion der Schubrate (im Vergleich zu Placebo) in verschiedene Wirksamkeitskategorien eingeteilt (Abb. 65.3, Tab. 65.2)
- Kategorie 1 (30-50% Reduktion vs. Placebo): Beta-Interferone (Interferon-β 1a/1b, pegyliertes Interferon-β 1a), Dimethylfumarat, Diroximelfumarat, Glatirameracetat, Teriflunomid. Das auch dazugehörige Azathioprin sollte nur in Ausnahmefällen verwendet werden.
- Kategorie 2 (50-60% Reduktion vs. Placebo): Cladribin, Fingolimod, Ozanimod, Ponesimod
- Kategorie 3 (>60% Reduktion vs. Placebo und >40% vs. Kategorie 1): Alemtuzumab, CD20-Antikörper (Ocrelizumab, Ofatumumab, Ublituximab, Rituximab), Natalizumab
- nach Erstdiagnose sollte primär eine Substanz aus Kategorie 1 verwendet werden. Die Entscheidung für einen Wirkstoff aus erfolgt nach Komorbiditäten sowie individueller Faktoren des Patienten
- bei therapienaiven Patienten mit „wahrscheinlich hochaktivem“ Verlauf sollen Wirkstoffe aus den Kategorien 2 und 3 verwendet werden
- ein „wahrscheinlich hochaktiver Verlauf“ kann anhand klinischer und kernspintomographischer Befunde angenommen werden:
- Initialschub führt trotz Schubtherapie zu einem schweren alltagsrelevanten Defizit
- die ersten beiden Schübe bilden sich schlecht zurück
- hohe Schubfrequenz (≥2 im ersten Jahr, ≥3 in ersten beiden Jahren)
- EDSS ≥3 oder Pyramidenbahnbeteiligung im ersten Jahr
- zum Diagnosezeitpunkt im cMRT ≥2 Gadolinium-aufnehmende Läsionen oder eine hohe Läsionslast (vor allem spinal und infratentoriell)
- hierbei ist zu berücksichtigen, dass die Beurteilung der Schubfrequenz und Schubschwere retrospektiv erfolgt und nicht auf weitere Krankheitsaktivität gewartet werden sollte
- die MS Therapeutika benötigen in der Regel 1-6 Monate, um eine vollständige Wirksamkeit zu entfalten. Somit kann eine Wirksamkeit erst nach frühestens 6 Monaten abgeschätzt werden. MRT Kontrollen sollten somit 6 und 18 Monate nach Therapiebeginn erfolgen, im weiteren Verlauf abhängig vom Erkrankungsverlauf und dem Sicherheitsprofil (in der Regel jährlich).
- bei „entzündlich aktivem“ Krankheitsverlauf trotz Therapie aus Kategorie 1 (erneuter eindeutiger Schub, Schub mit Nachweis ≥ 1 Läsion im MRT, zu ≥ 2 Zeitpunkten ≥ 1 neue Läsion im MRT, deutliche Zunahmen der Läsionslast im MRT) sollte auf ein Medikament aus den Kategorien 2 oder 3 gewechselt werden
- Kategorie 3 differenziert nach JC-Virus Antikörperstatus. Bei JC-Virus negativen Patienten sind Natalizumab und CD20 Antikörper die erste Wahl, bei JC-Virus positivem Status die Verwendung eines CD20-Antikörpers (Ocrelizumab, Ofatumumab, Ublituximab, Rituximab). Rituximab ist in Deutschland nur off-label einsetzbar
- Alemtuzumab wird nur noch in Ausnahmefällen angewendet. Mitoxantron soll nicht mehr eingesetzt werden
- unter Therapien aus allen Kategorien sind unterschiedlich häufige Labor- und Verlaufskontrollen nötig (Tab. 65.2)
- unter Therapie mit Natalizumab, Fingolimod und Dimethylfumarat ist das Auftreten einer progressiven multifokalen Leukenzephalopathie (PML) möglich.
- mit Abstand am häufigsten tritt die PML unter Natalizumab-Therapie auf (Mittelwert 4,22/1000 Patienten). Hier erfolgt vor und unter Therapie eine PML-Risikostratifizierung anhand von JC-Virusserologie (JCV-Titer) und bisherigen immunsuppressiven Vortherapien. Weitaus seltener wird eine PML unter Fingolimod (ca. 0,06/1000 Patienten) und Dimethylfumarat (ca. 0,025/1000 Patienten) beobachtet, bei Dimethylfumarat scheint eine Lymphopenie (<500/µl) als Risikofaktor eine Rolle zu spielen
- sollten sich unter Therapie mit Natalizumab, Fingolimod und Dimethylfumarat Hinweise auf eine PML ergeben, muss diese sofort inklusive invasiver Diagnostik abgeklärt werden (LP, cMRT, ggf. Biopsie)
- bei geplantem Therapiewechsel von Natalizumab auf lang wirksame Medikamente (Cladribin, Ocrelizumab, Alemtuzumab) kann bei Patienten mit erhöhtem PML-Risiko vor Therapiestart mit Ocrelizumab ein PML-Ausschluss mittels cMRT, LP und JCV-PCR erwogen werden
- auch bei der RRMS ist ein therapienaives Zuwarten unter engmaschigen Kontrollen möglich, wenn aus der initialen Präsentation, MRT-Parametern (Läsionslast), Liquorbefunden und dem zeitlichen Verlauf von einer milden Krankheitsaktivität auszugehen ist
|
|
||
|
UAW: Flush, Diarrhö, selten GI-Beschwerden KI: Überempfindlichkeit, schwere Erkrankung des Gastrointestinaltraktes, chronisch-entzündliche Darmerkrankungen, schwere Leber-/Nierenerkrankung, Schwangerschaft, Stillzeit |
||
|
|
||
|
|
||
|
|
||
|
1. Jahr: 1,75mg/kg kumulativ über 2 Zyklen á 4–5 Tage (Monat 1, 2) 2. Jahr: 1,75mg/kg kumulativ über 2 Zyklen á 4–5 Tage (Monat 13, 14 nach Therapiebeginn) |
|
|
|
0,5mg p.o. 1-mal/Tag (Erstapplikation unter kardiovaskulärem Monitoring) |
|
|
|
|
||
|
UAW: Transaminasenerhöhung, Bradyarrhythmie, Makulaödem, PRES, Basaliom KI: Herzrhythmusstörungen (Sick-Sinus, AV-Block, QTc-Verlängerung), Leberinsuffizienz, Immundefizienz, chronische Infektionen, Malignom, Makulaödem, Schwangerschaft, Stillzeit |
||
|
Genotypisierung von CYP2C9 obligat vor Therapiebeginn
|
||
|
|
||
|
Initialdosis: 2-mal 300mg i.v. im Abstand von 2 Wochen ODER einmalig 920mg s.c. |
|
|
|
|
||
|
Initialdosis: 2-mal 1000mg i.v. im Abstand von 2 Wochen Folgedosis: 500-1000mg i.v. alle 6 Monate (auch andere Schemata möglich) |
|
|
|
Initialdosis: 150mg i.v. und 450mg i.v. im Abstand von 2 Wochen |
|
|
|
|
||
|
HIV: humanes Immundefizienzvirus, HSV: Herpes-simplex-Virus, ITP: idiopathische thrombozytopenische Purpura, KI: Kontraindikationen, PML: progressive multifokale Leukenzephalopathie, PRES: posteriores reversibles Enzephalopathiesyndrom, TEN: toxische epidermale Nekrolyse, UAW: unerwünschte Arzneimittelwirkungen |
||
Therapie des klinisch isolierten Syndroms
- Patienten mit klinisch isoliertem Syndrom und hohem Risiko für eine erneute Krankheitsaktivität sollen früh mit einer krankheitsmodifizierenden Therapie behandelt werden.
- zugelassen sind Interferon-β 1a/1b und Glatirameracetat. Die Wahl des passenden Wirkstoffs erfolgt anhand vorliegender Komorbiditäten und individueller Wünsche des Patienten (Injektionshäufigkeit) (Tab. 65.2, Abb. 65.3).
- ein Zuwarten ohne Immuntherapie kann unter engmaschiger Überwachung erwogen werden, wenn aus der initialen Präsentation, MRT-Parametern (Läsionslast), Liquorbefunden und dem zeitlichen Verlauf von einer milden Krankheitsaktivität auszugehen ist
- Patienten mit DME sollten nur in Ausnahmefällen immuntherapeutisch behandelt werden. Hier sind engmaschige klinische und kernspintomographische Kontrollen angezeigt
Therapie des radiologisch isolierten Syndroms
-
Patienten mit neu-diagnostiziertem RIS werden in der Regel nicht primär immuntherapiert
-
bei RIS-Patienten mit erhöhtem Risiko für eine klinische Progression (oligoklonale Banden im Liquor und MRT-Progression in Verlaufskontrollen) kann eine off-label Immuntherapie aus der Kategorie 1 erwogen werden. Dies wird durch rezente randomisierte Studien unterstützt
Therapie der sekundär chronisch-progredienten Multiplen Sklerose
-
mit Hinblick auf die Immuntherapie der SPMS wird eine „aktive“ von einer „nicht-aktiven“ SPMS unterschieden
-
eine „aktive SPMS“ liegt dann vor, wenn weiterhin aufgesetzte Schübe vorliegen oder paraklinisch im MRT eine entzündliche Erkrankungsaktivität (neue Läsionen, Gadolinium-Aufnahme) vorliegt
-
bei Konversion einer RRMS in eine SPMS sollte die bestehende Immuntherapie auf die Wirksamkeit bei SPMS überprüft und ggf. angepasst werden
-
bei aktiver SPMS kann eine Immuntherapie mit Siponimod, Interferon-β 1a/1b, Cladribin, Ponesimod oder CD20-Antikörpern erfolgen (Abb. 65.3)
-
bei nicht behandelten Patienten mit „nicht aktiver SPMS“ soll keine Immuntherapie eingeleitet werden, bei jenen unter Kategorie 1 Immuntherapie soll die bestehende Therapie beendet werden. Im Einzelfall kann bei rascher Zunahme der Behinderung ein Therapieversuch über 2 Jahre mit CD20-Antikörpern erfolgen
-
vor allem junge Patienten mit kurzer Krankheitsdauer, geringem Behinderungsgrad und hoher inflammatorischer Krankheitsaktivität profitieren von einer Immuntherapie
-
eine Mitoxantron-Therapie wird aufgrund möglicher erheblicher Nebenwirkungen nicht mehr empfohlen
Therapie der primär chronisch-progredienten Multiplen Sklerose
-
In der PPMS-Therapie kommen nur die CD20-Antikörper Ocrelizumab und Rituximab (off label) zum Einsatz. Die Dosierung und Applikation erfolgt analog zu Patienten mit RRMS (Tab. 65.2, Abb. 65.3)
-
Ausweislich der Zulassungsstudien profitieren vor allem junge PPMS-Patienten (≤50 Jahre) von einer Ocrelizumab-Therapie. Der Einsatz bei älteren Patienten sollte nur beim Nachweis entzündlicher Aktivität in der MRT unter Berücksichtigung der Komorbiditäten und der möglichen Nebenwirkungen erwogen werden
Pharmakotherapie
Schubtherapie
- Die medikamentöse Therapie eines Krankheitsschubes erfolgt primär durch eine Hochdosis-Kortikosteroidpulstherapie. In der Regel werden 500 bis 1000mg Methylprednisolon i.v. täglich über 3 bis 5 Tage unter Magenschutz und Thromboseprophylaxe verabreicht. Anschließend kann eine orale Ausschleichphase (z.B. 100mg Methylprednisolon, Reduktion über 10–14 Tage) erfolgen (v.a. bei nicht ausreichender Symptombesserung)
- Falls nach dem ersten Kortikosteroidpuls innerhalb von 2 Wochen keine relevante Symptombesserung eintritt, kann im Anschluss eine eskalierte Kortikosteroidpulstherapie (2000mg Methylprednisolon täglich über 3 bis 5 Tage unter Magenschutz, Thromboseprophylaxe) erfolgen. Die Wirksamkeit eines zweiten Kortikosteroidpuls ist allerdings durch Studien nicht belegt
- Im Falle einer ausbleibenden Besserung unter einfachem und eskaliertem Kortikosteroidpuls sollte eine Plasmaseparation oder Immunadsorption diskutiert werden (primär an MS-Zentren). Für diese Therapie liegt eine klare Evidenz beim schweren Schub vor. Plasmaseparation und Immunadsorption gelten als gleichwertig, standardmäßig erfolgen 5 Zyklen, bei protrahiertem klinischen Ansprechen maximal 7 Zyklen (1 Zyklus täglich oder alle 2 Tage)
- Das Zeitfenster für eine Schubtherapie liegt innerhalb der ersten 4–6 Wochen nach Symptombeginn. In Ausnahmefällen (starke Beeinträchtigung) kann eine Schubtherapie bis 12 Wochen nach Symptombeginn erwogen werden
- Die Durchführung einer Schubtherapie hat keinen Einfluss auf den langfristigen Krankheitsverlauf und ersetzt nicht die medikamentöse krankheitsmodifizierende Therapie
Symptomatische Therapie
-
Spastik:
-
engmaschige und regelmäßige Physiotherapie als Basistherapie (2-3 Mal pro Woche)
-
unterstützend medikamentöse antispastische Therapie mittels Baclofen (Tagesdosis 30–75mg in 3 Einzeldosen), Tizanidin (Tagesdosis 12–24mg in 3–4 Einzeldosen) oder Gabapentin (Tagesdosis 1200–2700mg in 3–4 Einzeldosen)
-
primär pharmakologische Monotherapie, im Verlauf auch Kombinationstherapie möglich; bei unzureichender Wirkung additiv Sativex (Cannabinoid-haltiges oromukosales Spray) oder bei Unverträglichkeit andere Cannabinoide anwenden; bei allen Wirkstoffen vorsichtige Eindosierung
-
bei hochgradiger Spastik intrathekale Baclofen-Therapie (Baclofen-Pumpe) oder lokale Therapie mit Botulinumtoxin A erwägen
-
-
Ataxie/Tremor:
-
engmaschige Physio- und Ergotherapie als Basistherapie
-
unterstützend Therapieversuch bzgl. Tremor mit Propanolol, Primidon oder Topiramat möglich, Wirksamkeit jedoch nicht eindeutig belegt
-
bei schwerem Tremor eine Therapie mit Botulinumtoxin A oder in Einzelfällen eine Tiefenhirnstimulation erwägen
-
-
Fatigue:
-
primär nicht medikamentöse Therapie durch kognitive Verhaltenstherapie (Tagesstrukturierung), Gruppentherapie, psychologische Intervention
-
pharmakologischer Therapieversuch mit Amantadin (Tagesdosis 200–300mg in 2 Einzeldosen) oder Modafinil (Tagesdosis 200–400mg in 1–2 Einzeldosen) in Einzelfällen möglich, Wirksamkeit jedoch nicht belegt
-
-
kognitive Dysfunktion:
-
störungsspezifisches, PC-gestütztes Training im Rahmen einer neuropsychologischen Therapie
-
primär Aufmerksamkeitstraining, Verhaltenstherapie und begleitende Psychotherapie
-
eine Therapie mit Donepezil, Rivastigmin oder Memantin wird ausweislich der aktuellen Studienlage derzeit nicht empfohlen
-
-
Blasenfunktionsstörung:
-
Verhaltenstherapie als Basistherapieansatz, ergänzend Beckenbodentraining und Biofeedbackverfahren
-
intermittierende Selbstkatheterisierung bei Blasenentleerungsstörung mit Restharnbildung und häufigen Harnwegsinfekten
-
unterstützend medikamentöse Therapie mit Anticholinergika bei hyperaktiver Blase (z.B. Oxybutynin, Trospiumchlorid, Tolterodin) oder Desmopressin-Nasenspray bei Pollakisurie
-
bei schwerwiegender Blasenfunktionsstörung neurourologische Vorstellung zur intravesikalen Botulinumtoxin-A-Therapie oder sakralen Neuromodulation
-
-
sexuelle Dysfunktion:
-
kognitive Verhaltenstherapie in Kombination mit medikamentösem Therapieansatz
-
bei Erektionsstörungen Therapieversuch mit Sildenafil (25–50mg), Tadalafil (10–20mg) oder Vardenafil (10–20mg)
Zellbasierte Verfahren
Stammzelltransplantation
Die autologe hämapoetische Stammzelltransplantation hat sich in kleinen Studien als wirksam bei der schubförmig verlaufenden Multiplen Sklerose gezeigt. Allerdings sind die Langzeitfolgen der Therapie noch unklar. Die Stammzelltransplantation ist aktuell nicht zur Behandlung der MS zugelassen. Somit sollte diese Therapie nur im Rahmen von Studien durchgeführt werden.
Nachsorge
- Bei therapienaiven MS-Patienten in der Initialphase zumindest halbjährliche klinische Verlaufskontrollen empfohlen. Verlaufskontrollen mittels cMRT initial im Monat 6 und Monat 18, dann nach Krankheitsverlauf (meist jährlich). Im Fall eines stabilen Verlaufs danach auch längere Kontrollintervalle möglich.
- Unter MS-Immuntherapie sind abhängig vom Wirkstoff teils engmaschige Verlaufskontrollen obligat (Tab. 65.3).
|
C-reaktives Protein |
Blutbild + Differenzialblutbild |
Kreatinin, GFR |
||||||||
|
Alemtuzumab16, 17 |
||||||||||
|
Im Falle von Normabweichungen engmaschigere Kontrollabstände; 1 nach 1 Jahr alle 6-12 Monate; 2 bei Therapiebeginn nach 1 Monat, nach 1 Jahr alle 6-12 Monate 3 nach 1 Jahr alle 6-12 Monate; 4 nach 6 Monaten alle 2 Monate; dann Bestimmung von GPT ausreichend; 5 halbfährlich Blutdruck messsen; 6 Krebsvorsorge nach Standardleitlinie sowie regelmäßige Blutbildkontrollen bis mind. 5 Jahre nach Therapieende; 7 zusätzlich vor jedem Applikationszyklus; 8 in Monat 1 alle 2 Wochen; 9 bei Therapiebeginn zusätzlich nach 4 Wochen; 10 Vorschlag der Autoren; 11 nach 3 Monaten fakultativ alle 6 Monate; 12 erstmals nach 2 Jahren Therapie; falls negativ Bestimmung alle 6 Monate; 13 nach 2 Jahren Therapie abh. vom PML-Risiko alle 6-12 Monate; 14 zusätzlich alle 6 Monate Gesamt-IgG im Serum und Lymphozytensubpopulation (CD19+ B Zellen); 15 zusätzlich vor jeder Infusion Schwangerschaftstest; 16 2 Wochen vor bis 2-3 Wochen nach Infusionszyklus Verzicht auf rohes Fleisch, rohe Milch, unpasteurisierter Milchprodukte; 17 zusätzlich gynäkologische Vorstellung inkl. HPV-Screening alle 12 Monate; 18 Laborkontrollen über 48 Monate nach letzter Infusion; GFR: glomeruläre Filtrationsrate, GGT: γ-Glutamyltransferase, GOT: Glutamat-Oxalazetat-Transaminase, GPT: Glutamat-Pyruvat-Transaminase, TSH: Thyreoidea-stimulierendes Hormon, M: Monate, W: Wochen |
||||||||||
Verlauf und Prognose
-
der Krankheitsverlauf ist interindividuell sehr unterschiedlich, eine genaue Prognoseabschätzung zu Beginn der Erkrankung ist derzeit nicht möglich.
-
unbehandelt treten bei der RRMS durchschnittlich 0,3–0,5 Schübe pro Jahr auf, im Krankheitsverlauf Abnahme der Schubrate.
-
neuere Kohortenstudien legen eine im Vergleich zur Vergangenheit günstigeren langfristigen Krankheitsverlauf nahe, am ehesten aufgrund neuer therapeutischer Optionen und vermehrter Diagnosestellung bei milden Verlaufsformen (neuen Diagnosekriterien, besserer Zugang zur Diagnostik). Demnach erreichen etwa 5-10% aller Patienten einen EDSS von 6.0 nach 10 Jahren
-
nach 25 Jahren sind ein Drittel der MS-Patienten noch arbeitsfähig und ein Drittel der Patienten rollstuhlgebunden. Diese Daten entstammen älteren Studien, eine Besserung der langfristigen Prognose aufgrund neuer Therapieoptionen ist wahrscheinlich.
-
als prognostisch ungünstig gelten unter anderem:
-
männliches Geschlecht
-
ein polysymptomatischer Beginn
-
schwere, langanhaltende Schübe mit inkompletter Rückbildung
-
≥2 Gadolinium aufnehmenden Läsionen oder eine hohe T2-Läsionslast mit besondere Gewichtung infratentorieller und spinaler Läsionen bei Erstmanifestation
-
zudem ist die Zeit bis zum Erreichen eines EDSS von 4.0 prognostisch bedeutsam. Darüber hinaus existieren zahlreiche weitere Prognosefaktoren, die derzeit in der Praxis jedoch nur eine untergeordnete Rolle spielen
-
-
Prognostisch günstig sind:
-
Erkrankungsbeginn vor dem 35. Lebensjahr mit monosymptomatischer Erstmanifestation
-
überwiegend kurze Schübe mit sensibler Symptomatik und guter Rückbildungstendenz
-
eine niedrige T2-Läsionslast in der cMRT
-
Literatur
Quellenangaben
- [1] Awad A, Hemmer B, Hartung HP et al. Analyses of cerebrospinal fluid in the diagnosis and monitoring of multiple sclerosis. J Neuroimmunol 2010; 219: 1–7
Suche in: PubMed Google Scholar - [2] Comi G, Radaelli M, Soelberg Sorensen P. Evolving concepts in the treatment of relapsing multiple sclerosis. Lancet 2016; 389: 1347–1356
Suche in: PubMed Google Scholar - [3] Deutsche Gesellschaft für Neurologie (DGN), Kompetenznetz Multiple Sklerose (KKNMS), Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen, 1. Aktualisierung als Living Guideline 2023
Suche in: PubMed Google Scholar - [4] Kompetenznetz Multiple Sklerose (KKNMS), Qualitätshandbuch für MS, NMOSD und MOGAD, Stand 01/2023, MS-Qualitätshandbuch
- [5] Hemmer B, Kerschensteiner M, Korn T. Role of the innate and adaptive immune responses in the course of multiple sclerosis. Lancet Neurol 2015; 14: 406–419
Suche in: PubMed Google Scholar - [6] Ramagopalan SV, Dobson R, Meier UC et al. Multiple sclerosis: risk factors, prodromes, and potential causal pathways. Lancet Neurol 2010; 9: 727–739
Suche in: PubMed Google Scholar - [7] World Health Organization (WHO). Atlas multiple sclerosis resources in the world 2008. Genf: WHO; 2008
Suche in: PubMed Google Scholar - [8] Thompson AJ, Baranzini SE, Geurts J, Hemmer B, Ciccarelli O, Multiple Sclerosis. Lancet 2018; 391: 1622-1636
Suche in: PubMed Google Scholar - [9] Solomon AJ et al, Differential diagnosis of suspected multiple sclerosis: an updated consensus approach. Lancet Neurol 2023; 22: 750-768
Literatur zur weiteren Vertiefung
- Deutsche Gesellschaft für Neurologie (DGN), Kompetenznetz Multiple Sklerose (KKNMS), Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen, Entwicklungsstufe S2k, 2. Aktualisierung als Living Guideline 2023
- Suche in: PubMed Google Scholar
Kompetenznetz Multiple Sklerose (KKNMS), Qualitätshandbuch für MS, NMOSD und MOGAD, Stand 01/2024, MS-Qualitätshandbuch
Wichtige Internetadressen
- Kompetenznetz Multiple Sklerose KKNMS: www.kompetenznetz-multiplesklerose.de
- Qualitätshandbuch für MS, NMOSD und MOGAD: https://ms-qualitaetshandbuch.de/
- Deutsche Gesellschaft für Neurologie DGN: www.dgn.org
- Deutsche Multiple Sklerose Gesellschaft DMSG: www.dmsg.de
- European Committee for Treatment and Research in Multiple Sclerosis ECTRIMS: www.ectrims.eu
- Atlas of MS: www.atlasofms.org
Herausgeber*innen, Autor*innen und Aktualisierung
Herausgeber*innen: Hans-Christoph Diener, Helmuth Steinmetz, Oliver Kastrup
Autor*innen: Benjamin Knier, Bernhard Hemmer
Letzte Änderung: 02.09.2024