Multiple Sklerose
Radiologie
Inhaltsverzeichnis
- Steckbrief
- Synonyme
- Keywords
- Definition
- Epidemiologie
- Ätiologie und Pathogenese
- Klassifikation und Risikostratifizierung
- Symptomatik
- Methode der Wahl
- Pathognomonische Befunde
- Befundbeschreibung
- Radiologische Differenzialdiagnosen
- Typische Fehler
- Was der zuweisende Kollege/Kliniker wissen muss
- Besonderheiten bei bestimmten Personengruppen
- Literatur
Steckbrief
Die Multiple Sklerose ist die häufigste chronisch-entzündliche demyelinisierende Erkrankung des zentralen Nervensystems bei jungen Erwachsenen. Ihr wesentliches Merkmal ist das zeitlich und örtlich disseminierte Auftreten fokaler und diffuser inflammatorisch-demyelinisierender Läsionen in der weißen und grauen Substanz sowie neurodegenerativer Veränderungen. Neben der klinischen Untersuchung und der Liquordiagnostik kommt der MRT des Gehirns und des Rückenmarks bei der Diagnose und Verlaufsbeobachtung der Multiplen Sklerose eine entscheidende Rolle zu. Durch den sensitiven Nachweis der demyelinisierenden Läsionen in bestimmten anatomischen Lokalisationen (periventrikulär, juxtakortikal bzw. kortikal, infratentoriell und spinal) ermöglicht die MRT eine frühe und sichere Diagnose.
Synonyme
-
MS
-
Encephalomyelitis disseminata
Keywords
-
Enzephalomyelitis
-
Myelitis
-
Inflammation
-
Neurodegeneration
-
Pharmakovigilanz
-
zentrales Venenzeichen
-
Clinically isolated Syndrome
Definition
Die Multiple Sklerose ist eine autoimmun vermittelte, chronisch-entzündliche demyelinisierende und neurodegenerative Erkrankung des zentralen Nervensystems. Die entzündlichen Manifestationen laufen dabei zeitlich und örtlich disseminiert ab. Dies bedeutet, dass sowohl klinische als auch radiologische Manifestationen zeitlich voneinander getrennt verschiedene Regionen des zentralen Nervensystems betreffen.
Epidemiologie
Häufigkeit
-
Mit ca. 200 000 Multiple-Sklerose-Fällen in Deutschland und mehr als 2 Millionen betroffenen Patienten und Patientinnen weltweit zählt die Multiple Sklerose zu den häufigsten neurologischen Erkrankungen.
-
Die weltweite Prävalenz wird mit 50:100 000–300:100 000 angegeben.
-
Die Häufigkeit unterliegt starken geografischen Einflüssen. Dabei nimmt im Allgemeinen (abgesehen von einigen Ausnahmen) die Häufigkeit mit der Distanz zum Äquator zu.
Altersgipfel
-
Das typische Manifestationsalter liegt zwischen dem 20. und dem 40. Lebensjahr.
-
Ältere Betroffene (über 60 Jahre) mit einer Erstmanifestation haben häufiger eine primär progressive Verlaufsform.
Geschlechtsverteilung
-
Frauen sind 2- bis 3-mal häufiger betroffen als Männer.
Prädisponierende Faktoren
-
Umweltbedingte Risikofaktoren (Vitamin-D-Defizit, Rauchen, Übergewicht, Infektionen mit beispielsweise Epstein-Barr-Virus)
-
genetische Risikofaktoren (HLA-DRB1–1501 als Hauptrisikogen, ansonsten zahlreiche weitere „Immungene“ mit jeweils geringen Einzeleffekten)
Ätiologie und Pathogenese
-
Histopathologisch zeichnet sich die Multiple Sklerose durch multifokale Demyelinisierungsherde in der weißen und grauen Substanz mit vor allem in der weißen Substanz deutlich sichtbarer Entzündungsreaktion und mikroglialer Aktivierung aus.
-
Ein wichtiges Charakteristikum ist die sog. perivaskuläre, also an kleine Venolen angrenzende Entzündungsreaktion mit Demyelinisierung, die letztendlich zu den charakteristischen bildgebenden Befunden führt.
Klassifikation und Risikostratifizierung
-
Die Klassifikation ergibt sich aus dem klinischen Stadium bzw. dem klinischen Verlauf:
-
radiologisch isoliertes Syndrom (Multiple-Sklerose-typische MRT-Befunde ohne aktuelle oder vorangegangene klinische Symptomatik),
-
klinisch isoliertes Syndrom,
-
schubförmig-remittierende Multiple Sklerose,
-
sekundär chronisch-progrediente Multiple Sklerose,
-
primär progressive Multiple Sklerose.
-
-
Die Risikostratifizierung für die Entwicklung der Erkrankung ergibt sich aus den prädisponierenden Faktoren.
Symptomatik
- Bei der Mehrzahl der Patienten und Patientinnen manifestiert sich die Multiple Sklerose erstmalig mit einem monosymptomatischen oder polysymptomatischen neurologischen Ereignis, dem sog. klinisch isolierten Syndrom (Clinically isolated Syndrome).
- Typische Symptome sind die Optikusneuritis, motorische oder sensible Ausfälle, Ataxie sowie Blasen- und Mastdarmstörungen.
- Bei den meisten Patientinnen und Patienten nimmt die Erkrankung einen schubförmig-remittierenden Verlauf mit neuen neurologischen Symptomen, die sich zunächst noch vollständig zurückbilden können und im weiteren Verlauf häufig klinische Residuen hinterlassen.
- In späteren Stadien kann sich daraus ein sekundär chronisch-progredienter Verlauf mit oder ohne auftretende Schübe entwickeln. Insbesondere kognitive Symptome als Ausdruck der Schädigung der grauen Substanz sind für die Betroffenen im weiteren Krankheitsverlauf sehr einschränkend und belastend.
| Merke Eine Minderheit der Patienten und Patientinnen entwickelt von Beginn an einen chronisch-progredienten Verlauf ohne klinisch messbare Schübe. |
Methode der Wahl
-
Die MRT des Gehirns und des Rückenmarks ist neben der klinischen und der Liquoruntersuchung die entscheidende diagnostische Modalität und in den Multiple-Sklerose-Diagnosekriterien fest verankert.
-
Die jüngste Revision der sog. McDonald-Kriterien (Tab. 9.1) erlaubt bei einer entsprechenden klinischen Symptomatik die Diagnose einer Multiplen Sklerose mit einer einzelnen MRT-Untersuchung des Gehirns bzw. Rückenmarks. Voraussetzung ist, dass radiologisch eine örtliche und zeitliche Dissemination der entzündlichen Veränderungen nachweisbar ist.
-
Die Rolle der Bildgebung bei der Multiplen Sklerose geht dabei weit über die Diagnose hinaus:
-
Die Information hinsichtlich Anzahl sowie Lokalisation der Multiple-Sklerose-Läsionen zu Beginn der Erkrankung liefert wichtige Daten zur Prädiktion des Krankheitsverlaufs.
-
Darüber hinaus ist die MRT die Methode der Wahl, um den Krankheitsverlauf, insbesondere die Effizienz der Therapie, zu überwachen und sog. subklinische Krankheitsaktivität zu detektieren. Dadurch kann die Therapie ggf. frühzeitig zu einem noch effektiveren Therapeutikum eskaliert werden.
-
Auch für das Sicherheitsmonitoring der Multiple-Sklerose-Therapie spielt die MRT eine entscheidende Rolle und erlaubt eine frühzeitige Diagnose möglicher Therapiekomplikationen (z.B. einer progressiven multifokalen Leukenzephalopathie).
-
Sehr wichtig sind für alle Indikationsgebiete die bildmorphologische Abgrenzung zu wichtigen Differenzialdiagnosen (z.B. vaskulären Erkrankungen) und die interdisziplinäre Interpretation der MRT-Daten zusammen mit der klinischen Präsentation und laborchemischen sowie elektrophysiologischen Daten.
-
-
Trotz der hohen Sensitivität und der charakteristischen Bildbefunde bleibt die Beurteilung der MRT für die Diagnose und Verlaufsbeobachtung der Multiplen Sklerose im klinischen Alltag regelmäßig eine Herausforderung. Der Grund ist, dass wichtige Differenzialdiagnosen sowie mögliche Komorbiditäten und fehlerhafte Standardisierungen der Bildakquisition wichtige potenzielle Fehlerquellen darstellen.
-
Das empfohlene Untersuchungsprotokoll ist sehr stark abhängig von der klinischen Situation (z.B. Erstdiagnose, Monitoring der Therapieeffizienz bzw. Therapiesicherheit). Tab. 9.2 gibt einen Überblick über die empfohlenen Akquisitionsprotokolle des Gehirns und des Rückenmarks für die entsprechenden klinischen Indikationen.
-
Aufgrund der nachgewiesenen höheren Sensitivität bei höheren magnetischen Feldstärken wird für das Gehirn formell eine Feldstärke von 3 T empfohlen, eine Feldstärke von 1,5 T ist aber ausreichend. Für die Bildgebung des Rückenmarks hat eine Feldstärke von mehr als 1,5 T keinen Mehrwert.
|
simultane Anwesenheit einer gadolinium- und nicht gadoliniumanreichernden Läsion zu einem beliebigen Zeitpunkt |
|
|
neue T2w und/oder gadoliniumanreichernde Läsion auf einem Follow-up-MRT-Bild im Vergleich zu einem Referenz-MRT-Bild |
|
|
Gehirn (empfohlene örtliche Auflösung für die 2-D-Akquisition: 3-mm-Schichtdicke [kein Gap], 1 × 1 mm In-Plane-Auflösung; für 3-D-Akquisition isotroper Datensatz mit einer gemessenen Voxelgröße von [vorzugsweise] 1 × 1 × 1 mm) |
||||
|
(empfohlene örtliche Auflösung für die 2-D-Akquisition: 3-mm-Schichtdicke [kein Gap], 1 × 1 mm In-Plane-Auflösung) |
||||
|
sagittale protonendichtegewichtete (Turbo-/Fast-)Spin-Echo-Sequenz7) |
||||
|
sagittale T1w (Turbo-/Fast-)Spin-Echo-Sequenz nach Kontrastmittelgabe4) |
||||
|
axiale T1w (Turbo-/Fast-)Spin-Echo-Sequenz nach Kontrastmittelgabe4) |
||||
|
sagittale protonendichtegewichtete (Turbo-/Fast-)Spin-Echo-Sequenz7) |
||||
|
sagittale T1w (Turbo-/Fast-)Spin-Echo-Sequenz nach Kontrastmittelgabe4) |
||||
|
axiale T1w (Turbo-/Fast-)Spin-Echo-Sequenz nach Kontrastmittelgabe4) |
||||
|
1) duales Echo (protonendichtegewichtete und T2w Sequenzen) als Alternative zu einer einzelnen stark T2w Sequenz 2) vorzugsweise 3-D-Akquisition mit multiplanaren Rekonstruktionen 3) keine Fettsupprimierung erforderlich 4) Standarddosis (0,1 mmol/kg Körpergewicht), makrozyklisches Gadolinium, minimales Delay zwischen Injektion und T1w Akquisition von 5 min 5) optional im Falle einer Verfügbarkeit einer qualitativ hochwertigen 3-D-FLAIR-Sequenz einschließlich multiplanarer Rekonstruktionen in axialer und sagittaler Orientierung 6) Der Begriff „Monitoring der Therapiesicherheit“ bezieht sich auf das Screening auf progressive multifokale Leukenzephalopathie vor allem bei mit Natalizumab behandelten Patienten und Patientinnen. 7) Es sollte entweder eine protonendichtegewichtete oder alternativ eine STIR-Sequenz angewendet werden. 8) Das MRT des Rückenmarks für das Monitoring der Therapieeffizienz ist im Allgemeinen nicht empfohlen und nur speziellen klinischen Indikationen vorbehalten. DIR = Double Inversion Recovery DWI=Diffusion-weighted Imaging FLAIR = Fluid-attenuated Inversion Recovery PSIR = Phase-sensitive Inversion Recovery |
||||
|
Praxistipp Obgleich die meisten Multiple-Sklerose-Läsionen im zervikalen Rückenmark lokalisiert sind, befindet sich ein substanzieller Anteil der Rückenmarkspathologie im kaudalen thorakalen Rückenmark. Deshalb wird die Bildgebung des gesamten Rückenmarks empfohlen. |
|
Merke Wichtig für alle Indikationen des Einsatzes der MRT bei der Multiplen Sklerose ist ein hohes Maß an Standardisierung der Bildakquisition. |
Pathognomonische Befunde
- Die Multiple Sklerose präsentiert sich im MRT mit charakteristischen Befunden, die detailliert in der Befundbeschreibung dargestellt werden. Diese sind jedoch nicht als pathognomonisch anzusehen, da sie zum Teil eine größere Überlappung mit einem breiten Spektrum an Differenzialdiagnosen haben.
Befundbeschreibung
MRT
Typischer Fall
-
Gehirn:
-
Der typische MRT-Befund einer Multiplen Sklerose beinhaltet multifokale Demyelinisierungsherde in der weißen und grauen Hirnsubstanz (Abb. 9.1). Die fokalen Läsionen sind T2w hyperintens und, abhängig vom Grad der Demyelinisierung bzw. des periläsionalen Ödems, iso- bis hypointens auf den T1w Aufnahmen.
-
Als sog. Black Holes werden T1w hypointense Läsionen auf kontrastverstärkten T1w (Turbo-)Spin-Echo-Sequenzen bezeichnet, die transiente bzw. chronische Demyelinisierung und/oder ein intra- bzw. periläsionales Ödem repräsentieren.
-
T1w hypointense Läsionen können sich wieder nahezu vollständig zu weißer Substanz mit normaler Signalintensität entwickeln. Das wird als Remyelinisierung interpretiert (transiente Black Holes).
-
Im Rahmen einer aktiven bzw. (sub-)akuten Entzündung kommt es häufig zu einer Störung der Blut-Hirn-Schranke mit konsekutiver Kontrastmittelanreicherung. Das Muster der Schrankenstörung kann sehr heterogen sein, von punktförmig über patchy bis ringförmig (s. Abb. 9.1d).
-
Die Läsionsmorphologie beinhaltet ein breites und heterogenes Spektrum. Dabei weisen perivaskulär orientierte Läsionen in der tiefen und/oder periventrikulären weißen Substanz häufig eine klassische längsovale Form auf (sog. Dawson Finger). Die Läsionen kommen häufig in charakteristischen Lokalisationen vor, die für den Nachweis der örtlichen Dissemination in die Diagnosekriterien (s. Tab. 9.1) Eingang gefunden haben.
-
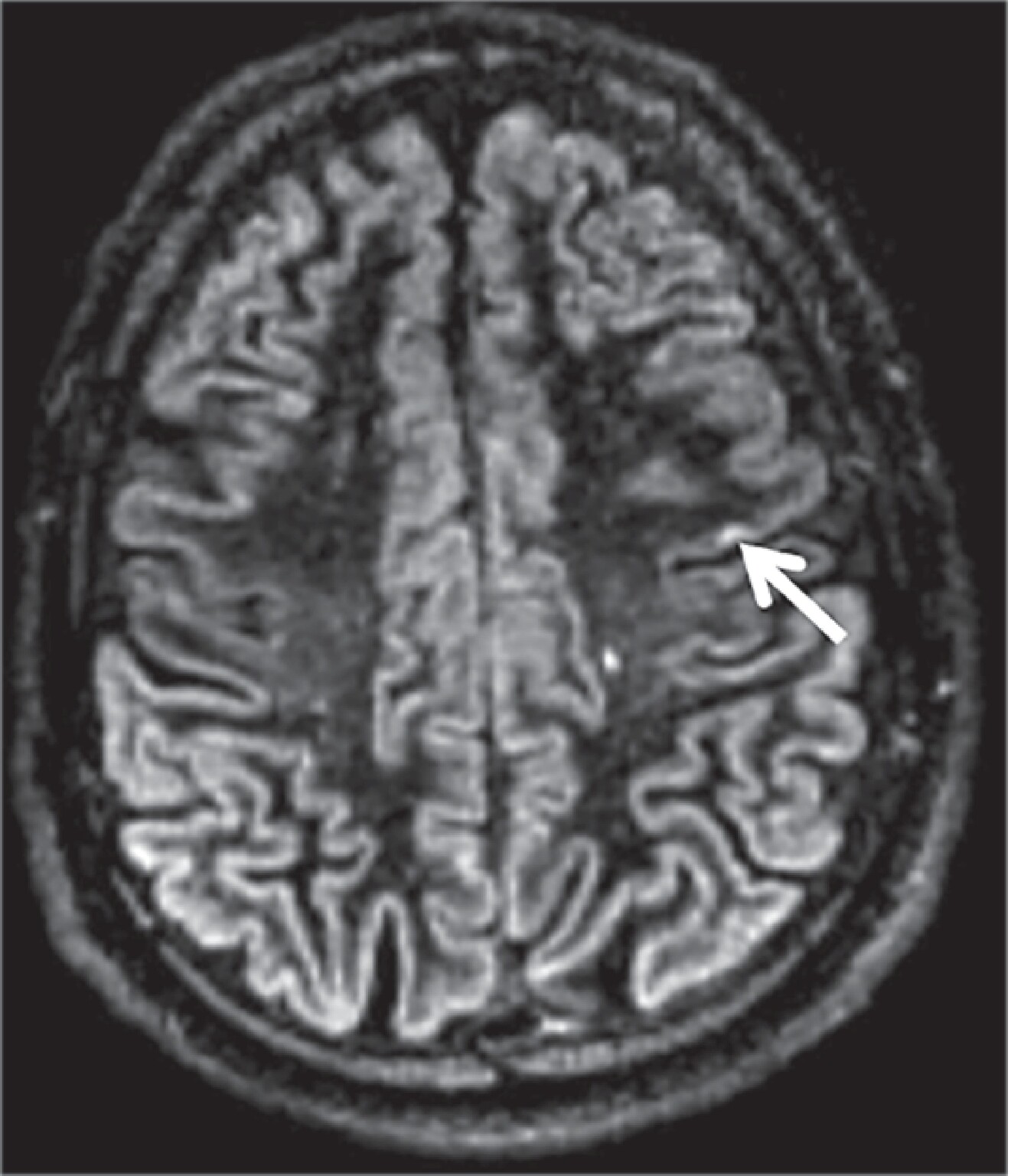
Neben den klassischen Veränderungen in der weißen Substanz sind, abhängig von der Art und Qualität der Bildakquisition, fokale Läsionen in der kortikalen grauen Substanz zu detektieren, die histopathologisch klassifiziert werden (Abb. 9.2):
-
Typ 1: leukokortikale Läsion, die sich sowohl in der weißen als auch in der kortikalen grauen Substanz befindet,
-
Typ 2: kortikale Läsion, die ausschließlich im Kortex lokalisiert ist,
-
Typ 3: subpiale kortikale Läsion,
-
Typ 4: kortikale Läsion, die die gesamte Breite des Kortex einnimmt.
-
-
Zusätzlich zu den fokalen demyelinisierenden Läsionen findet insbesondere in progressiven Verlaufsformen auch eine diffuse Demyelinisierung statt, die im MRT als diffuse Erhöhung der T2w Signalintensität speziell in der weißen Substanz zu erkennen ist („Diffuse Abnormal White Matter“).
-
Neben den klassischen Bildbefunden gibt es bestimmte Sonderformen fokaler demyelinisierender Läsionen:
-
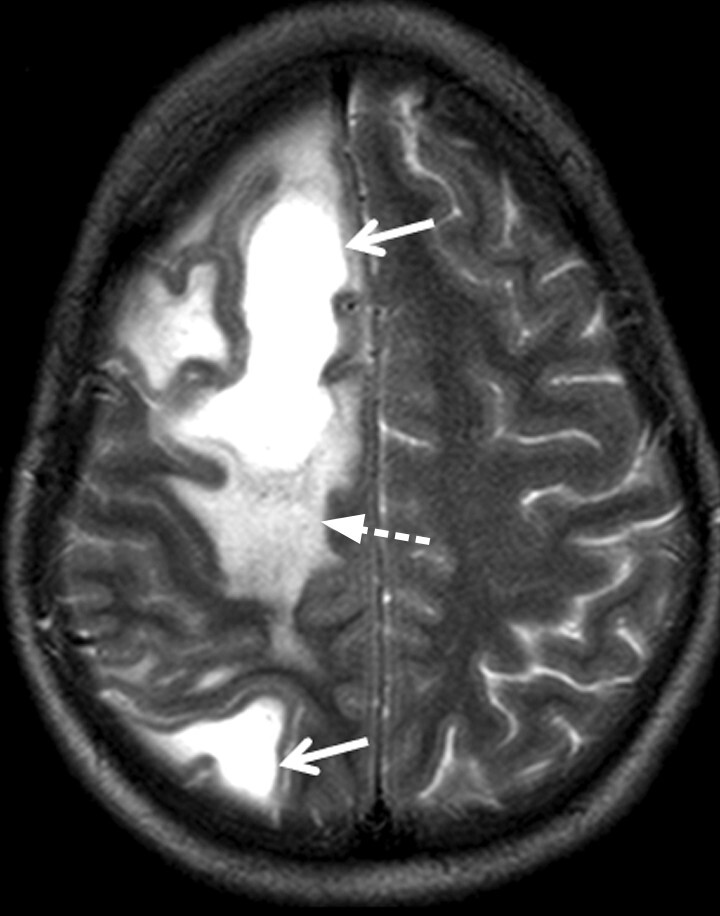
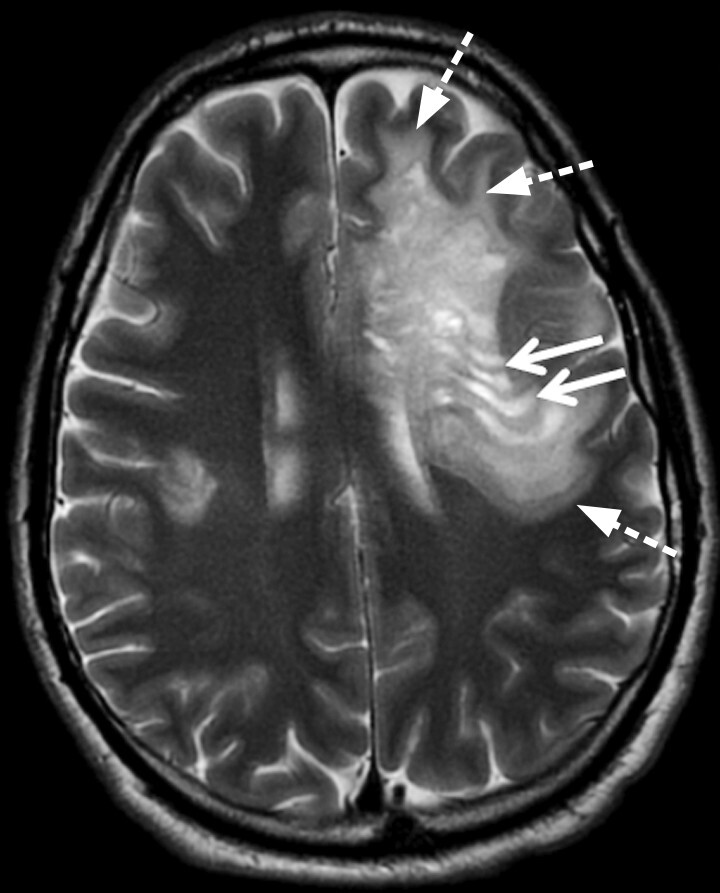
Tumefaktive Läsion: Dabei handelt es sich um große Läsionen (größer als 2 cm) mit raumforderndem Aspekt (Abb. 9.3). Diese weisen häufig ein perifokales Ödem und eine randständige Schrankenstörung auf. Charakteristischerweise ist die Schrankenstörung insbesondere in Richtung der kortikalen grauen Substanz unterbrochen („Open Ring Sign“).
-
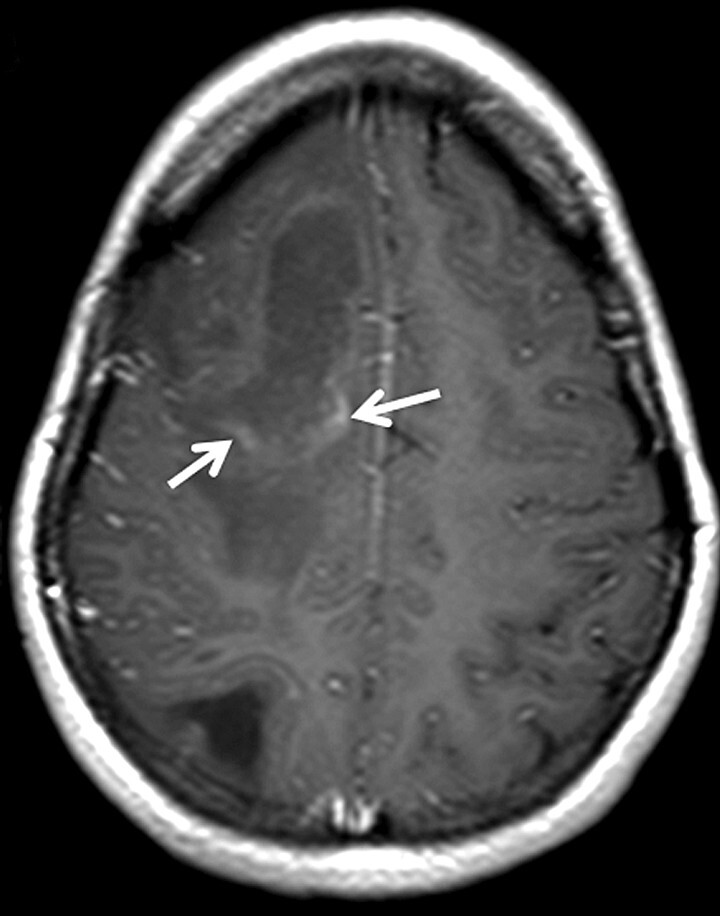
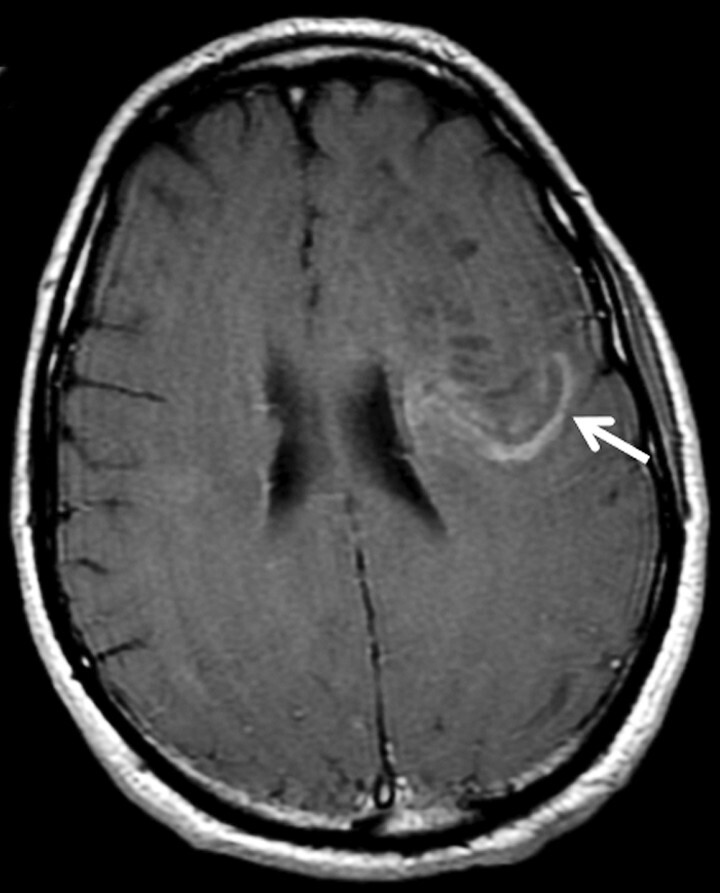
Baló-Läsion: Dieser als in erster Instanz im Rahmen der Subentität „konzentrische Sklerose“ beschriebene Läsionstyp zeigt eine ringförmige (zwiebelschalenartige) Anordnung von unterschiedlichen Graduierungen der Demyelinisierungen bzw. von noch normalem Myelin (Abb. 9.4).
-
-
Wichtige Läsionslokalisationen:
-
Juxtakortikal: Die Läsionen befinden sich in den U-Fasern direkt angrenzend an die kortikale graue Substanz (s. Abb. 9.1c). Zwischen kortikaler grauer Substanz und Läsion ist kein intaktes Myelin mehr erkennbar. Histopathologisch sind auf Basis des MRT als juxtakortikal klassifizierte Läsionen zum Teil auch in der angrenzenden weißen Substanz lokalisiert, sodass es sich häufig um Typ-1-Läsionen der grauen Substanz (leukokortikale Läsionen) handelt. Dies ist einer der Gründe, warum in den jüngsten Diagnosekriterien nicht mehr zwischen kortikalen und juxtakortikalen Läsionen unterschieden wird.
-
Periventrikulär: Die Läsionen grenzen direkt an den Seitenventrikel. Es ist kein intaktes Myelin mehr zwischen Läsion und Ventrikelwand zu erkennen (s. Abb. 9.1b). Definitionsgemäß gelten ausschließlich Läsionen angrenzend an den Seitenventrikel als periventrikulär. Läsionen angrenzend an den IV. Ventrikel werden als infratentorielle Läsionen angesehen.
-
Infratentoriell: Alle Läsionen unterhalb des Tentorium cerebelli (s. Abb. 9.1a) werden als infratentoriell kategorisiert. Prognostisch besondere Bedeutung haben Läsionen im Hirnstamm (Prädiktion von Langezeitbehinderung).
-
-
-
Rückenmark:
-
Das Rückenmark ist für die Diagnose und Prognose der Multiplen Sklerose von entscheidender Bedeutung. Es ist als anatomische Lokalisation zum Nachweis der örtlichen Dissemination in den Diagnosekriterien fest verankert (s. Tab. 9.1).
-
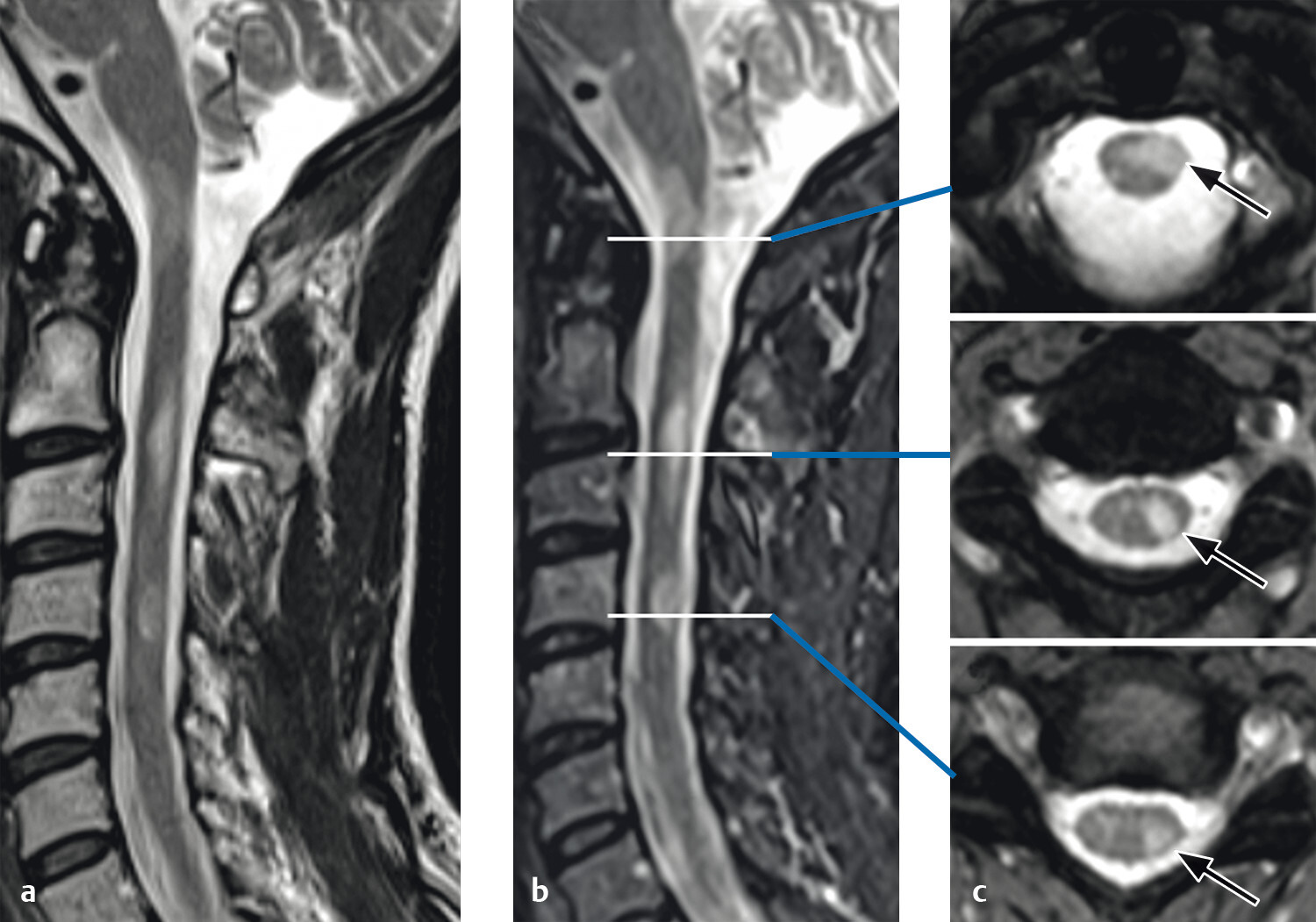
Es handelt sich in den meisten Fällen um kurzstreckige, T2w hyperintense fokale Demyelinisierungsherde, die vor allem die lateralen und posterioren Abschnitte des Rückenmarks betreffen (Abb. 9.5).
-
Ähnlich wie im Gehirn respektieren die Läsionen häufig die Grenzen zwischen grauer und weißer Substanz nicht, sodass viele Rückenmarksläsionen auch die zentrale graue Substanz miteinbeziehen.
-
Das Bild einer T1w hypointensen Läsion wie im Gehirn ist im Rückenmark nicht zu sehen.
-
Eine Schrankenstörung kommt im Rückenmark seltener vor als im Gehirn.
-
Die meisten Läsionen sind im zervikalen und im kaudalen thorakalen Rückenmark lokalisiert.
-
Ähnlich wie im Gehirn tritt auch im Rückenmark insbesondere in progressiven Krankheitsverläufen eine diffuse Demyelinisierung mit diffuser erhöhter T2w Signalintensität auf.
-
-
N. opticus:
-
Aufgrund der Häufigkeit einer Optikusneuritis, insbesondere als Erstmanifestation einer Multiplen Sklerose, sind Veränderungen des Sehnervs häufig zu beobachten.
-
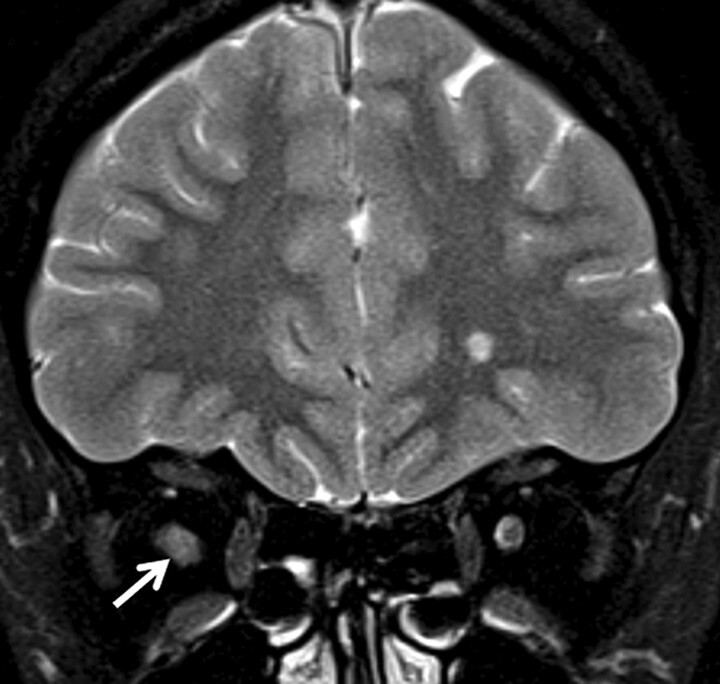
Das klassische Bild ist eine fokale, im Vergleich zur Neuromyelitis-optica-Spektrum-Erkrankung eher kurzstreckige, T2w hyperintense Läsion, die eine Schrankenstörung aufweisen kann.
-
Das Chiasma ist relativ ausgespart und perifokale bzw. perineurale Entzündungsreaktionen sind im Vergleich zur Anti-MOG-assoziierten Optikusneuritis eher seltener zu beobachten (Abb. 9.6).
-
Veränderungen der Retina können mit der optischen Kohärenztomografie näher klassifiziert und quantifiziert werden.
-
-
Leptomeningen:
-
Die Anwesenheit von sog. leptomeningealen B-Zell-Follikeln ist histopathologisch schon seit Längerem bekannt. Mithilfe kontrastverstärkter 3-D-FLAIR-Sequenzen sind diese kleinen leptomeningealen Areale als hyperintense Areale zu identifizieren.
-
Die Veränderungen sind aber für die Multiple Sklerose nicht spezifisch und bleiben über einen mehrjährigen Zeitraum konstant, sodass sie als diagnostischer Marker und zur Verlaufsbeurteilung nicht verwendet werden sollten.
-
-
Bildbefunde abhängig vom Krankheitsstadium und Verlauf:
-
Die Ausprägung bzw. das Muster der oben beschriebenen Bildbefunde ist abhängig vom Krankheitsverlauf und vom Krankheitsstadium.
-
Im Allgemeinen sind bei Patientinnen und Patienten mit primär chronisch-progredienter Multipler Sklerose mehr diffuse Veränderungen und Veränderungen im Rückenmark zu sehen.
-
Bei schubförmig remittierender Multipler Sklerose ist bei fortschreitendem Krankheitsverlauf und kurz vor Eintreten in die sekundär chronisch-progrediente Phase eine Beschleunigung der Pathologie in der grauen Substanz sowie im Rückenmark zu beobachten.
-
Akute Inflammation im Sinne von schrankengestörten Läsionen sind bei (chronisch) progressiven Verlaufsformen seltener zu beobachten und es kommt zu einer deutlichen Progression der Neurodegeneration mit progressiver Hirn- sowie Rückenmarksatrophie.
-
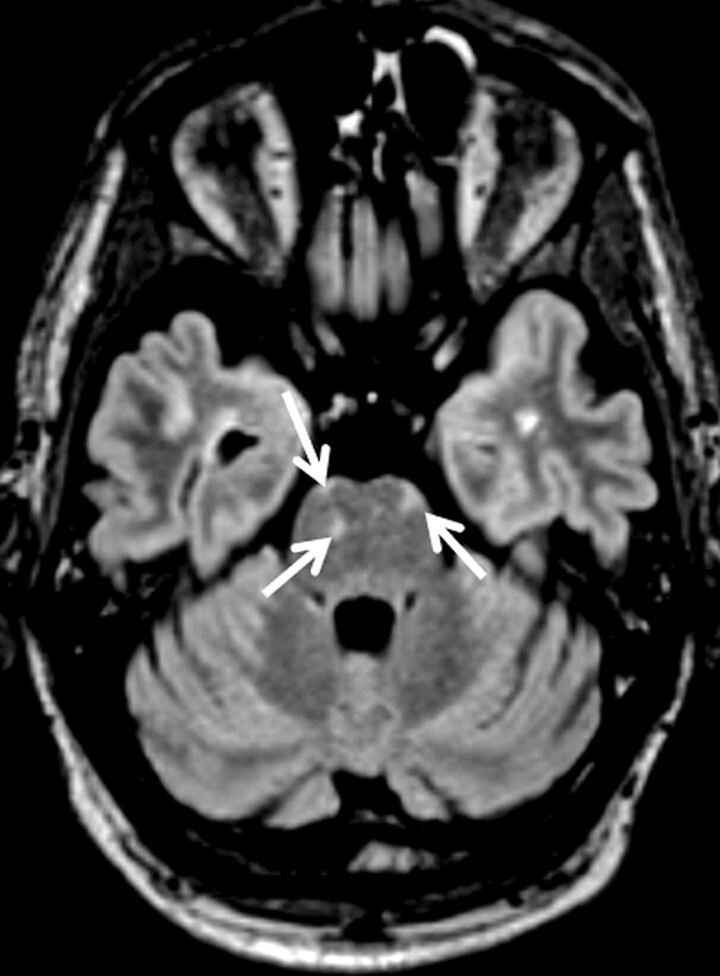
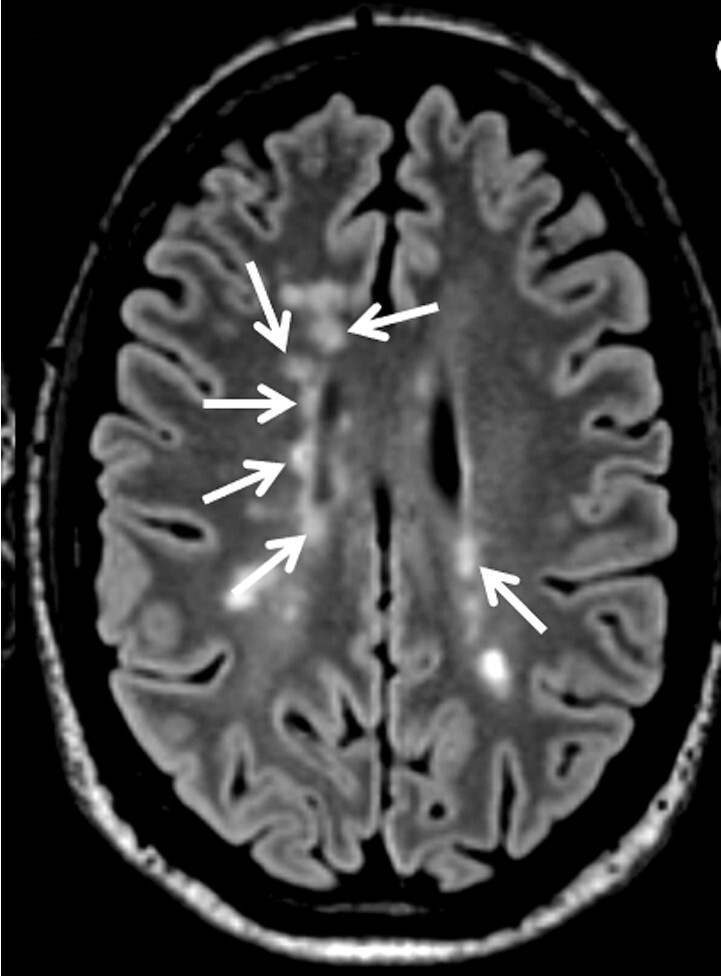
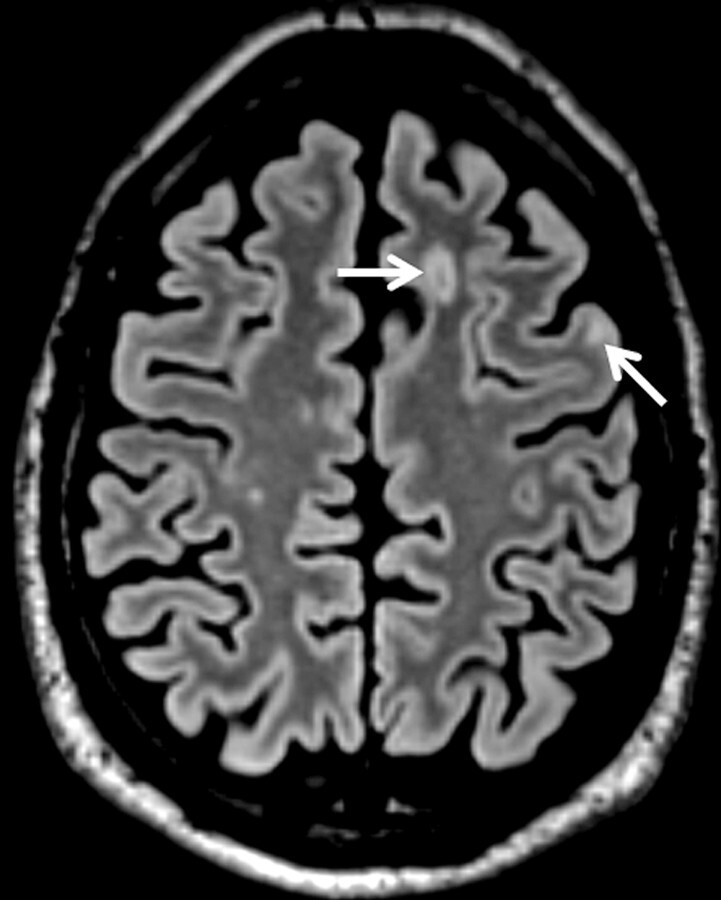
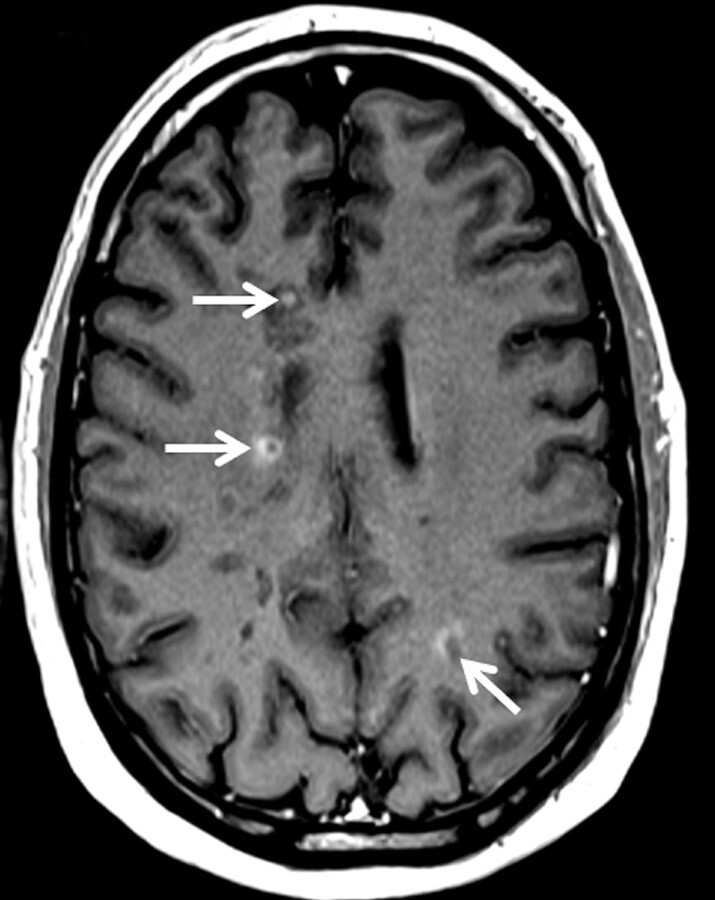
Abb. 9.1 Multiple Sklerose.
Die MRT-Bilder dokumentieren das typische anatomische Verteilungsmuster der Multiple-Sklerose-Läsionen.
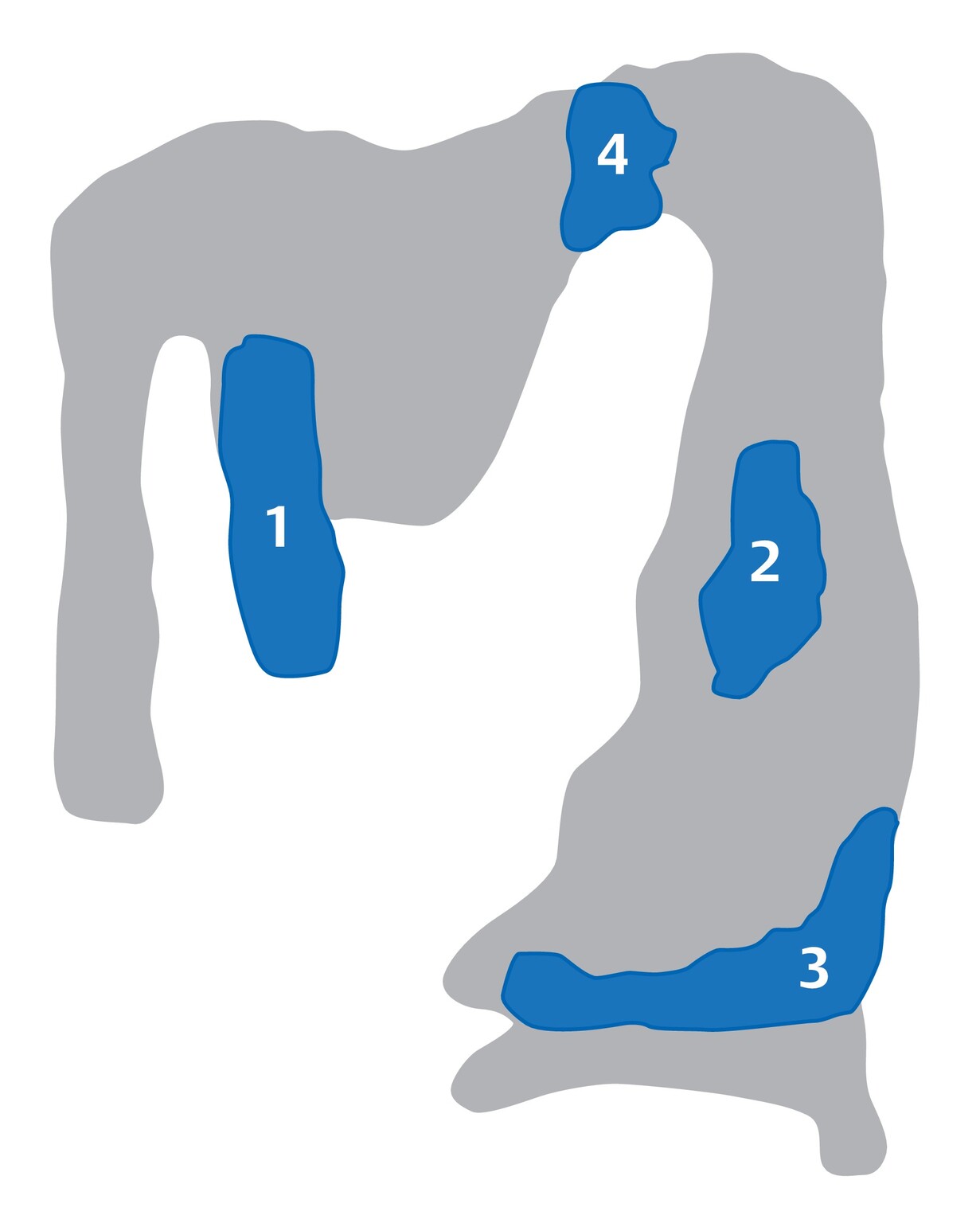
a Axiale FLAIR-MRT-Sequenz. Infratentorielle Läsionen, insbesondere Hirnstammläsionen (Pfeile), haben eine große prognostische Bedeutung zu Beginn der Erkrankung hinsichtlich der Entwicklung einer Langzeitbehinderung.
b Axiale FLAIR-MRT-Sequenz. Periventrikuläre Läsionen zeigen das typische perivaskuläre Verteilungsmuster (Pfeile).
c Axiale FLAIR-MRT-Sequenz. Juxtakortikale Läsionen (Pfeile) lassen sich kaum von kortikalen bzw. leukokortikalen Läsionen (s. Abb. 9.2) differenzieren.
d Kontrastverstärkte T1w MRT-Sequenz. Schrankengestörte Läsionen (Pfeile) als Zeichen akuter inflammatorischer Krankheitsaktivität.
Abb. 9.2 Multiple Sklerose.
a Illustrierung der Einteilung kortikaler Multiple-Sklerose-Läsionen. Die Ziffern kennzeichnen die 4 verschiedenen Typen.
b Axiale Double-Inversion-Recovery-MRT-Sequenz. Kortikale Multiple-Sklerose-Läsion (Pfeil).
Abb. 9.3 Multiple Sklerose.
Atypische inflammatorisch-demyelinisierende Läsion. Tumefaktive Multiple-Sklerose-Läsion (a, b, Pfeile) mit einer nicht vollständig ringförmigen Schrankenstörung („Open Ring Sign“) im Randbereich und perifokalem Ödem (a, gestrichelter Pfeil).
a Axiale T2w MRT-Sequenz.
b Kontrastverstärkte T1w MRT-Sequenz.
Abb. 9.4 Multiple Sklerose.
Atypische inflammatorisch-demyelinisierende Läsion. Baló-Läsion (a, b, Pfeile). Klassisches Bild der sog. zwiebelschalenartigen Anordnung von unterschiedlichen Graduierungen der Demyelinisierungen, in diesem Fall in Kombination mit einer Schrankenstörung und perifokalem Ödem (a, gestrichelte Pfeile).
a Axiale T2w MRT-Sequenz.
b Kontrastverstärkte T1w MRT-Sequenz.
Abb. 9.5 Multiple Sklerose.
Multifokale Multiple-Sklerose-Läsionen im zervikalen Myelon. Auf den axialen Bildern (c) sieht man die klassische Lokalisation in den posterioren und lateralen Anteilen, jedoch mit Beteiligung der zentralen grauen Substanz (c, Pfeile).
a Sagittale T2w MRT-Sequenz.
b Sagittale STIR-MRT-Sequenz.
c Axiale T2w MRT-Sequenz.
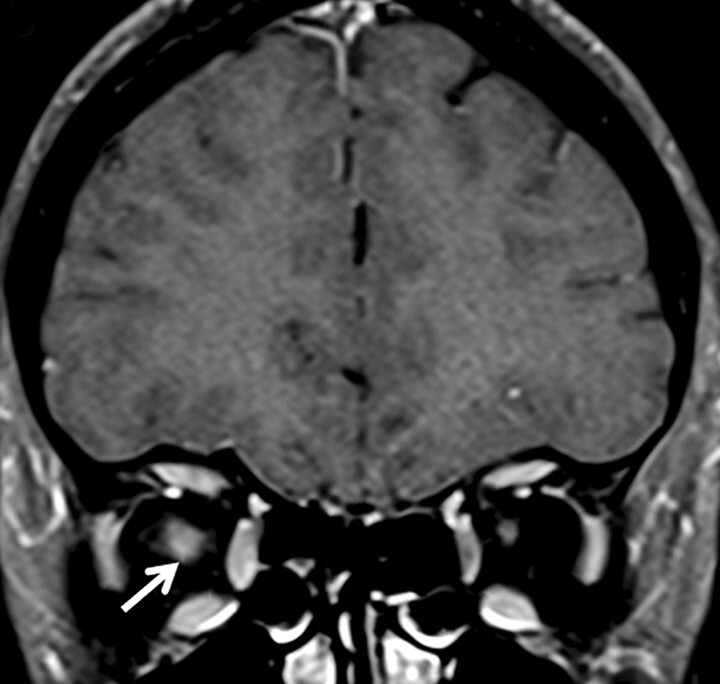
Abb. 9.6 Multiple Sklerose.
Dokumentation eines typischen Bildes einer Multiple-Sklerose-assoziierten Optikusneuritis. Der rechte N. opticus ist geschwollen und zeigt eine im Vergleich zur Gegenseite erhöhte T2w Signalintensität sowie in diesem Fall eine diskrete Schrankenstörung (Pfeile). Beachte die im Vergleich zur MOG-Immunglobulin-G-assoziierten Optikusneuritis fehlende entzündliche Begleitreaktion des angrenzenden orbitalen Fettgewebes.
a Koronare fettsupprimierte T2w MRT-Sequenz.
b Koronare kontrastverstärkte T1w MRT-Sequenz.
Atypischer Fall
- Gehirn: Neben den geschilderten Läsionen gibt es weitere seltene, sog. atypische demyelinisierende Läsionen im Rahmen der Multiplen Sklerose. Diesbezüglich wird auf die entsprechende Fachliteratur verwiesen.
Radiologische Differenzialdiagnosen
- Die Differenzialdiagnosen der Multiplen Sklerose sind vielfältig. Die wichtigsten Krankheitsbilder sind in Tab. 9.3 zusammengefasst.
|
Differenzialdiagnose (absteigend sortiert nach klinischer Relevanz) |
Häufigkeit der Differenzialdiagnose in Hinblick auf das Krankheitsbild (häufig, gelegentlich, selten) |
wesentliche diagnostisch richtungweisende Anamnese, Untersuchung und/oder Befunde |
|
|
vaskuläre Veränderungen (Small Vessel Disease, Mikroangiopathie) |
|
||
|
|||
|
systemischer Lupus erythematodes |
|
||
|
ADEM = akute disseminierte Enzephalomyelitis MOG = Myelin-Oligodendrozyten-Glykoprotein |
|||
| Cave Multiple-Sklerose-Patienten und -Patientinnen weisen häufig zusätzlich zu den Multiple-Sklerose-Läsionen eine vaskuläre Komorbidität auf. |
Typische Fehler
-
Unzureichende Standardisierung der Bildakquisition des Gehirns und des Rückenmarks
-
fehlerhafte Diagnose durch unzureichende differenzialdiagnostische Abgrenzung
-
fehlerhafte Anwendung der MRT-Befunde im Rahmen der McDonald-Kriterien
-
Überinterpretation fokaler Läsionen in der tiefen und periventrikulären weißen Substanz als mögliche Multiple-Sklerose-Läsionen (vaskuläre Komorbidität [Small Vessel Disease] kann bereits zum Zeitpunkt der Diagnosestellung vorhanden sein und kommt im weiteren Verlauf der Erkrankung häufig vor)
-
fehlende Detektion oder Interpretation von therapieassoziierten Komorbiditäten wie beispielsweise einer progressiven multifokalen Leukenzephalopathie (PML)
-
unzureichende Berücksichtigung der Befunde im Rückenmark (jeder Patient und jede Patientin mit Verdacht auf eine chronisch-entzündliche Erkrankung des Zentralnervensystems sollte ein kontrastmittelverstärktes MRT des Rückenmarks erhalten)
-
unzureichende Berücksichtigung fokaler Läsionen in der kortikalen und tiefen grauen Substanz
-
unzureichende Berücksichtigung diffuser demyelinisierender Läsionen (Diffuse Abnormal White Matter)
Was der zuweisende Kollege/Kliniker wissen muss
-
Diagnose:
-
Unterstützen die Bildbefunde (Läsionsmorphologie und Läsionsverteilung) die klinische Diagnose einer Multiplen Sklerose?
-
Sind die McDonald-MRT-Kriterien im Sinne einer örtlichen und/oder zeitlichen Dissemination erfüllt?
-
Welche Differenzialdiagnosen kommen neuroradiologisch in Betracht?
-
Welche prognostische Einschätzung zum Langzeitverlauf kann man aufgrund des MRT-Bildes treffen (z.B. Gesamtanzahl der Läsionen, Anzahl der Hirnstammläsionen, kortikale Läsionen, persistierende inflammatorische Krankheitsaktivität zu Beginn der Erkrankung)?
-
-
Verlaufsbeobachtung:
-
Gibt es Zeichen einer aktiven inflammatorischen Krankheitsaktivität (schrankengestörte Läsionen, neue oder größenprogrediente T2w Läsionen)?
-
Gibt es evidente Zeichen einer progredienten Neurodegeneration (neue T1w Black Holes, zunehmende bzw. visuell erkennbar zunehmende Atrophie des Gehirns und/oder des Rückenmarks)?
-
Gibt es Hinweise auf natürliche oder therapieassoziierte Komorbiditäten (z.B. vaskuläre Veränderungen, opportunistische Infektion)?
-
Besonderheiten bei bestimmten Personengruppen
Besonderheiten bei Schwangeren
-
Schwangerschaft und Stillzeit bieten der Patientin einen gewissen Schutz vor inflammatorischer Krankheitsaktivität. Insbesondere während der Schwangerschaft können jedoch Komorbiditäten (z.B. das posteriore reversible Enzephalopathiesyndrom) eine Multiple-Sklerose-Krankheitsaktivität vortäuschen.
-
Die Indikation zu einer MRT des Kopfes sollte bei unklaren neurologischen Befunden großzügig gestellt werden (auch im ersten Trimenon). Die Feldstärke sollte 1,5 T nicht überschreiten. Die Gabe von gadoliniumhaltigem Kontrastmittel ist absolut kontraindiziert.
Besonderheiten bei Kindern und Jugendlichen
-
Im Vergleich zum Erwachsenenalter ist Multiple Sklerose im Kindesalter viel seltener. Die Inzidenz wird mit 0,07:100 000–2,90:100 000 beschrieben.
-
Von allen Multiplen-Sklerose-Fällen findet lediglich bei 3–5% die Erstmanifestation vor dem 18. Lebensjahr statt.
-
Die deutliche weibliche Prädominanz (4,5:1) ist lediglich ab dem 12. Lebensjahr deutlich. Davor gibt es keine eindeutige Geschlechtspräferenz.
-
Bei Kindern wird fast ausschließlich ein schubförmig-remittierender Verlauf beobachtet. Die entzündliche Aktivität ist im Kindesalter deutlich höher als im Erwachsenenalter. Das drückt sich in der höheren jährlichen Schubrate aus.
-
Hinsichtlich der MRT-Befunde weisen adoleszente Kinder nahezu identische Befunde auf wie die Erwachsenen mit Multipler Sklerose. Bei jüngeren Kindern sind häufig untypische demyelinisierende Läsionen mit zum Teil unscharfen Begrenzungen zu beobachten.
| Merke Bei einem sehr hohen Anteil (bis zu 70%) der Kinder mit einem erstmaligen akuten demyelinisierenden Ereignis bleibt es bei einem monophasischen Ereignis ohne die Entwicklung einer klassischen Multiplen Sklerose. |
Literatur
Quellenangaben
-
[1] Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17 (2): 162–173. doi: 10.1016/S1474–4422(17)30470–2
Suche in: PubMed Google Scholar
Literatur zur weiteren Vertiefung
-
[1] Dekker I, Wattjes MP. Brain and spinal cord MR imaging features in multiple sclerosis and variants. Neuroimaging Clin N Am 2017; 27: 205–227. doi:10.1016/j.nic.2016.12.002
Suche in: PubMed Google Scholar -
[2] Filippi M, Brück W, Chard D et al. Association between pathological and MRI findings in multiple sclerosis. Lancet Neurol 2019; 18 (2): 198–210
Suche in: PubMed Google Scholar -
[3] Filippi M, Preziosa P, Banwell BL et al. Assessment of lesions on magnetic resonance imaging in multiple sclerosis: practical guidelines. Brain 2019; 142: 1858–1875
Suche in: PubMed Google Scholar -
[4] Parmar K, Banwell BL, Akbar N et al. Imaging pediatric multiple sclerosis-challenges and recent advances. Neuropediatrics 2018; 49: 165–172
Suche in: PubMed Google Scholar -
[5] Reich DS, Lucchinetti CF, Calabresi PA. Multiple sclerosis. N Engl J Med 2018; 378: 169–180
Suche in: PubMed Google Scholar -
[6] Rovira À, Wattjes MP, Tintoré M et al. Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis – clinical implementation in the diagnostic process. Nat Rev Neurol 2015; 11: 471–482. doi:10.1038/nrneurol.2015.106
Suche in: PubMed Google Scholar -
[7] Thompson AJ, Baranzini SE, Geurts J et al. Multiple sclerosis. Lancet 2018; 391: 1622–1636
Suche in: PubMed Google Scholar -
[8] Wallner-Blazek M, Rovira A, Fillippi M et al. Atypical idiopathic inflammatory demyelinating lesions: prognostic implications and relation to multiple sclerosis. J Neurol 2013; 260: 2016–2022
Suche in: PubMed Google Scholar -
[9] Wattjes MP, Rovira À, Miller D et al. Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis – establishing disease prognosis and monitoring patients. Nat Rev Neurol 2015; 11: 597–606
Suche in: PubMed Google Scholar -
[10] Wattjes MP, Ciccarelli O, Reich DS et al. 2021 MAGNIMS-CMSC-NAIMS consensus recommendations on the use of MRI in patients with multiple sclerosis. Lancet Neurol 2021; 20 (8): 653–670
Suche in: PubMed Google Scholar
Wichtige Internetadressen
-
Magnetic Resonance Imaging in Multiple Sclerosis (MAGNIMS): Netzwerk: www.magnims.eu
-
Kompetenznetzwerk Multiple Sklerose: www.kompetenznetz-multiplesklerose.de
-
The Consortium of Multiple Sclerosis Centers (CMSC): www.mscare.org
-
AMSEL – Das Multiple Sklerose Portal: www.amsel.de
-
Deutsche Multiple Sklerose Gesellschaft Bundesverband e.V. (dmsg): www.dmsg.de
Herausgeber*innen, Autor*innen und Aktualisierung
Herausgeber*innen: Michael Forsting, Olav Jansen
Autor*innen: Mike P. Wattjes
Letzte Änderung: 07.12.2022